近日,國家藥監局藥品審評中心(CDE)官網公示,諾華(Novartis)旗下放射性核藥镥[177Lu]特昔維匹肽注射液(商品名:Pluvicto)擬納入優先審評。這是該藥繼2024年9月在中國申報三線治療前列腺癌后,首次將適應癥前移至二線治療,標志著中國轉移性去勢抵抗性前列腺癌(mCRPC)患者有望更早獲得這一精準抗癌療法。
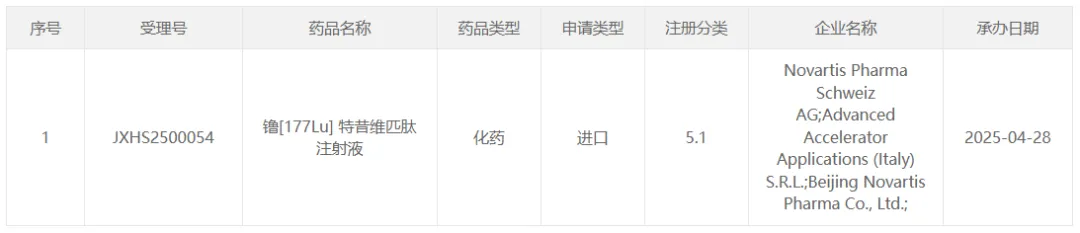
圖片來源:CDE 官網
Pluvicto是一種靶向前列腺特異性膜抗原(PSMA)的放射配體療法(RLT),其通過將放射性同位素镥-177與靶向配體結合,精準定位并殺死表達PSMA的癌細胞,同時減少對正常組織的損傷。此次申報的二線適應癥,針對的是接受過雄激素受體通路抑制劑(ARPI)治療但未接受化療的mCRPC患者,而此前已獲批的三線適應癥需患者經歷ARPI和紫杉類化療雙重治療失敗。
支持該適應癥的關鍵III期PSMAfore研究顯示,與更換ARPI方案相比,Pluvicto將患者的中位影像學無進展生存期(rPFS)從5.6個月延長至11.6個月,疾病進展或死亡風險降低59%(HR=0.41),且總緩解率達30%。安全性方面,主要不良事件如口干、疲勞等多為1-2級,未顯著影響后續化療可行性。
Pluvicto是諾華核藥領域的核心產品,藥智數據顯示,2024年全球銷售額達99億元人民幣,同比增長44%。若二線適應癥在中國獲批,其適用人群將擴大約三倍——中國多數前列腺癌患者初診時已處于中晚期,且mCRPC階段患者中位生存期僅1-2年,半數甚至無法活到接受二線治療。
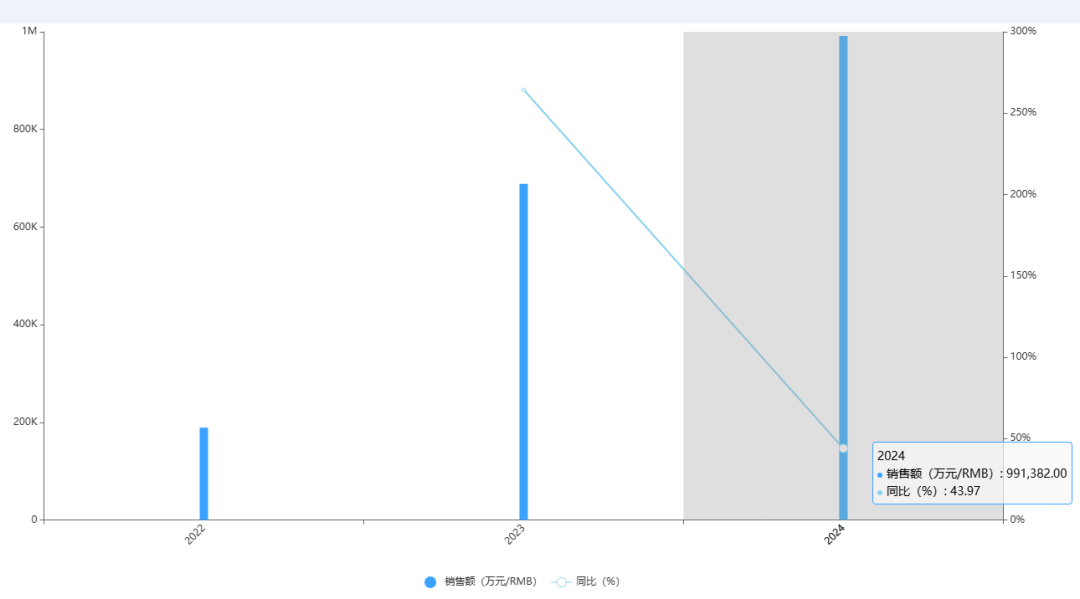
圖片來源:藥智數據——全球暢銷藥品銷售數據
諾華的野心不止于此。其正在中國開展II期研究(CTR20230581),探索Pluvicto在未經紫杉烷類藥物治療的mCRPC患者中的療效,并計劃將適應癥進一步拓展至轉移性激素敏感性前列腺癌(mHSPC)及乳腺癌、肺癌等實體瘤。
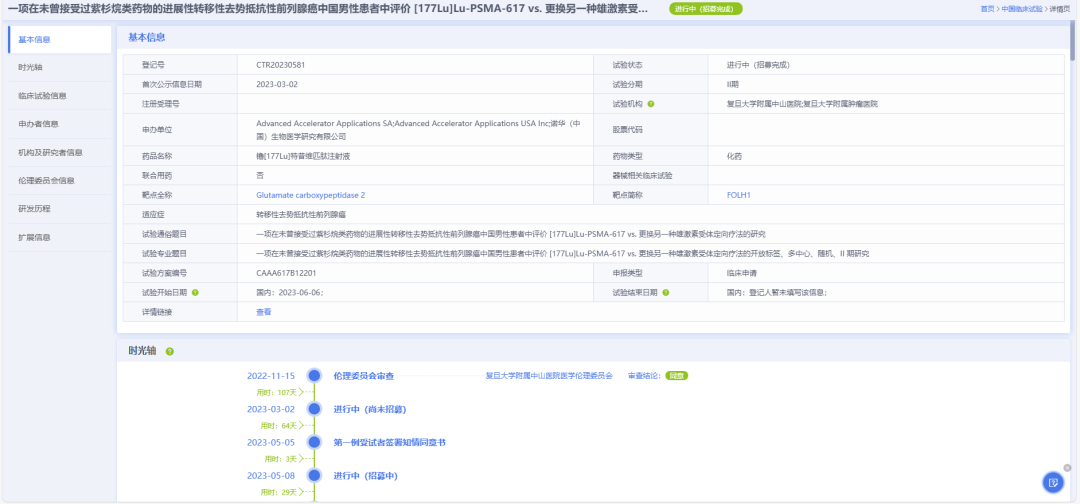
圖片來源:藥智數據——中國臨床試驗
Pluvicto的二線適應癥沖刺,標志著核藥從“小眾療法”向“主流治療”的跨越。對于患者,這意味著更早獲得生存獲益的機會;對于行業,則揭示了核藥在實體瘤中的廣闊前景。







