對于醫藥領域而言,決定一款創新藥市場空間的因素主要有二,即患者規模與支付意愿,這一點在全球新藥普遍集中于非小細胞肺癌、乳腺癌等領域就明顯可以看出。
而在上述兩者之外,結直腸癌的市場空間卻也似乎同樣不遜色。
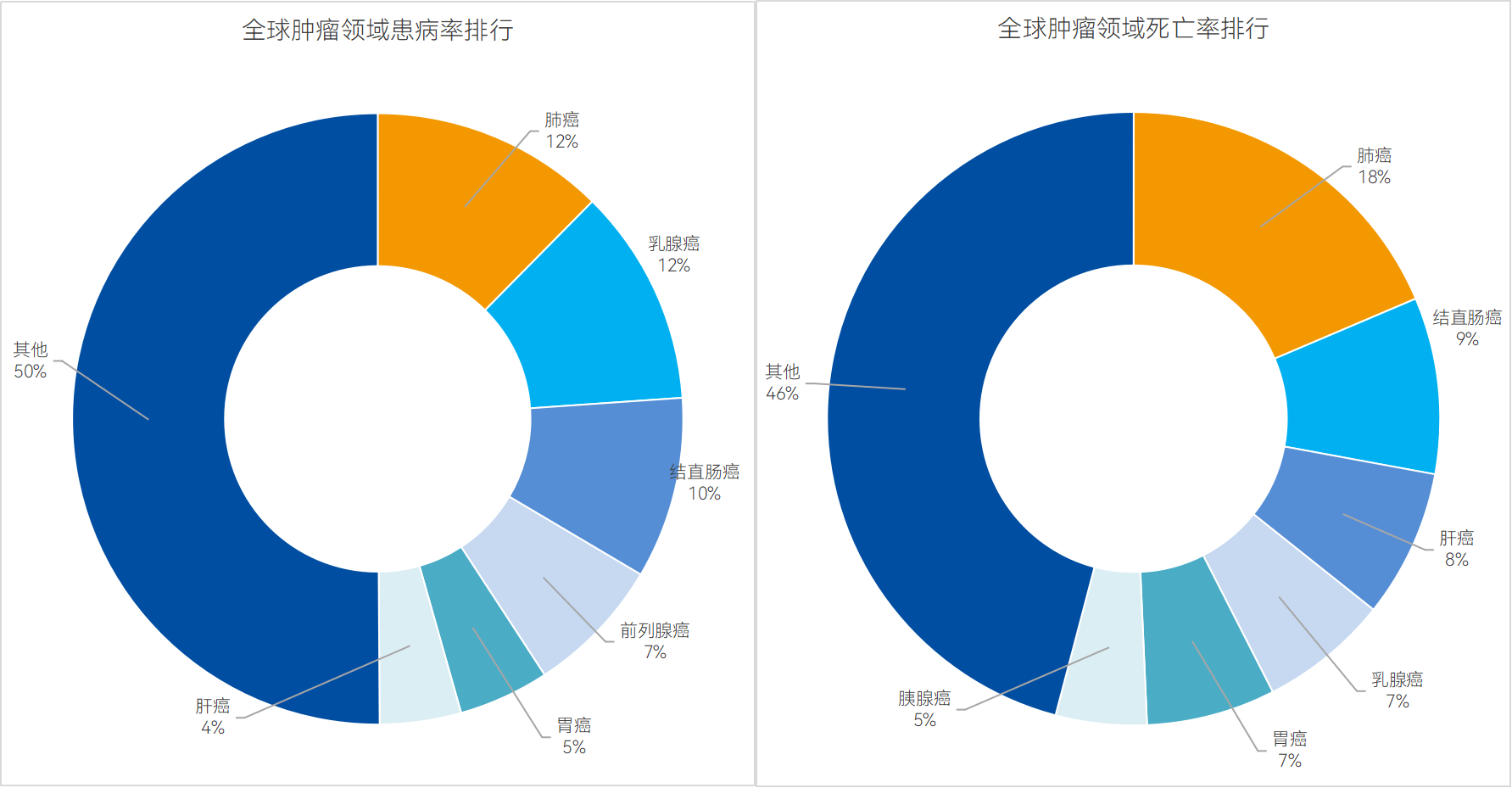
數據來源:全球衛生組織報告(點擊查看大圖)
就發病率而言,結直腸癌發病率居全球第三,占所有癌癥數量的10%,雖次于肺癌與乳腺癌,但數量差距卻并不大,同時,近年來結直腸癌發病率和死亡率均呈明顯上升趨勢,過去10年間,我國結直腸癌發病率增長126%,年均增長9.5%。
就死亡率而言,結直腸癌作為世界上癌癥相關死亡的第二大原因,其極大地刺激了患者的支付意愿。
可為什么明明理論上應該擁有強大市場空間的結直腸癌新藥,為何其整體格局上并未表現得如肺癌與乳腺癌那么光亮?屬于結直腸癌新藥的未來又何時能至?
治療局限
藥物治療更顯重要
首先,消化道腫瘤不同于肺癌、肝癌、淋巴癌等,其手術治療的難度與代價都更低,因此在結直腸癌的歷年治療中,理論上手術切除應該是其最主要的根治手段。
但實際情況上,結直腸癌患者的5年生存率普遍維持在65%左右,局部(未擴散)5年生存率雖可高達90%,但區域淋巴結轉移與晚期遠處轉移患者的5年生存率卻分別只有71%與14%。
這是因為,結直腸癌的早期大多沒有明顯癥狀,以至于臨床上超85%的確診患者普遍均為中晚期,早期識別診斷能夠徹底治愈的結直腸癌患者不足15%,這就導致本是根治有效的手術治療在實際臨床中的應用場景極為受限。
因此,臨床上迫切需要手術治療之外,能針對晚期、耐藥性、轉移復發性與治療副作用等痛點的治療手段,最終迫使醫學界加速探索新藥研發與治療策略的創新。
50年新藥沉寂
結直腸癌藥物治療的歷史
在過去結直腸癌腫瘤藥發展的60年歷史中,可主要分為五大治療階段,前40年里主要為傳統治療與化療,代表藥物為5-FU、伊立替康、卡培他濱、奧沙利鉑等;而近20余年結直腸癌治療快速發展,大量創新藥物研究涌現,靶向治療、免疫治療逐漸成為新的治療手段,結直腸癌治療也分別進入了靶向藥時代、免疫治療時代與小分子靶向藥時代。
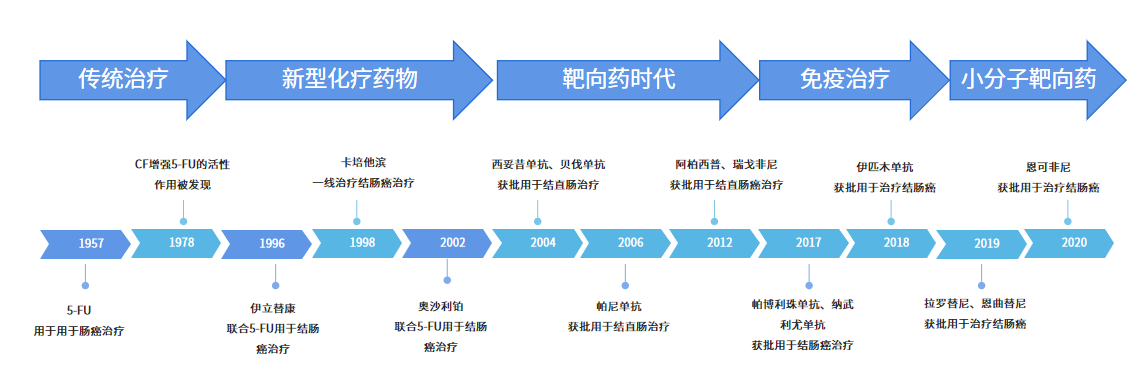
數據來源:公開數據整理
而更關鍵的是,一系列創新療法的出現,也正是結直腸癌治療中對臨床需求的不斷滿足,推動了結直腸癌治療格局的不斷成長。
毒副作用-由化療轉向靶向治療
在結直腸癌的傳統治療上,一系列化療藥物極易引發骨髓抑制、神經毒性及腸道損傷,強大的副作用導致患者的依從性與治療意愿均明顯下降,因此如何平衡療效與安全性成為重點,在此情況下,以西妥昔為首的靶向藥物誕生,極大地解決了相關難題。
耐藥性困境-由靶向治療轉向免疫治療
曾經,西妥昔單抗等靶向藥物的應用為結直腸癌治療帶來了曙光,但過程中卻約有40%的RAS野生型患者因繼發性耐藥導致治療失敗,研究發現KRAS/BRAF突變、HER2擴增、MET激活等分子機制推動耐藥性形成,此外,腫瘤微環境中的免疫抑制細胞(如Treg、MDSCs)進一步削弱藥物滲透與療效,而以帕博利珠單抗為首的免疫治療出現,使其與靶向治療雙劍合璧,鎖定癌細胞的致命弱點的同時,還能喚醒身體沉睡的抗癌力量,開創出了精準抗癌的新紀元。
技術+靶點
結直腸癌新藥的創新之路
據藥智數據顯示,目前全球“活躍”在研結直腸癌管線(包括上市藥品)共計271款,其中有23款新藥獲批上市,各自針對的適應癥存在較大差別;其次,有四款新藥處于注冊申請階段,有31款新藥進入了臨床Ⅲ期,119款新藥處于臨床Ⅱ期,94款新藥處于臨床I期,至于臨床前與臨床申請階段管線,由于無法判斷活躍情況,故不在統計范圍內。

數據來源:藥智數據、藥智咨詢整理
技術創新:ADC、雙抗前途無量
對于技術方向而言,271款活躍新藥管線中,化藥的整體占比最高,共有115款活躍新藥在研,其次是單抗、雙抗與ADC三個當今熱門的技術方向,分別有53款、22款與16款新藥在研;最后,TIL細胞、CAR-T、多肽等技術方向數量則多呈現個位趨勢,布局企業數量較少。
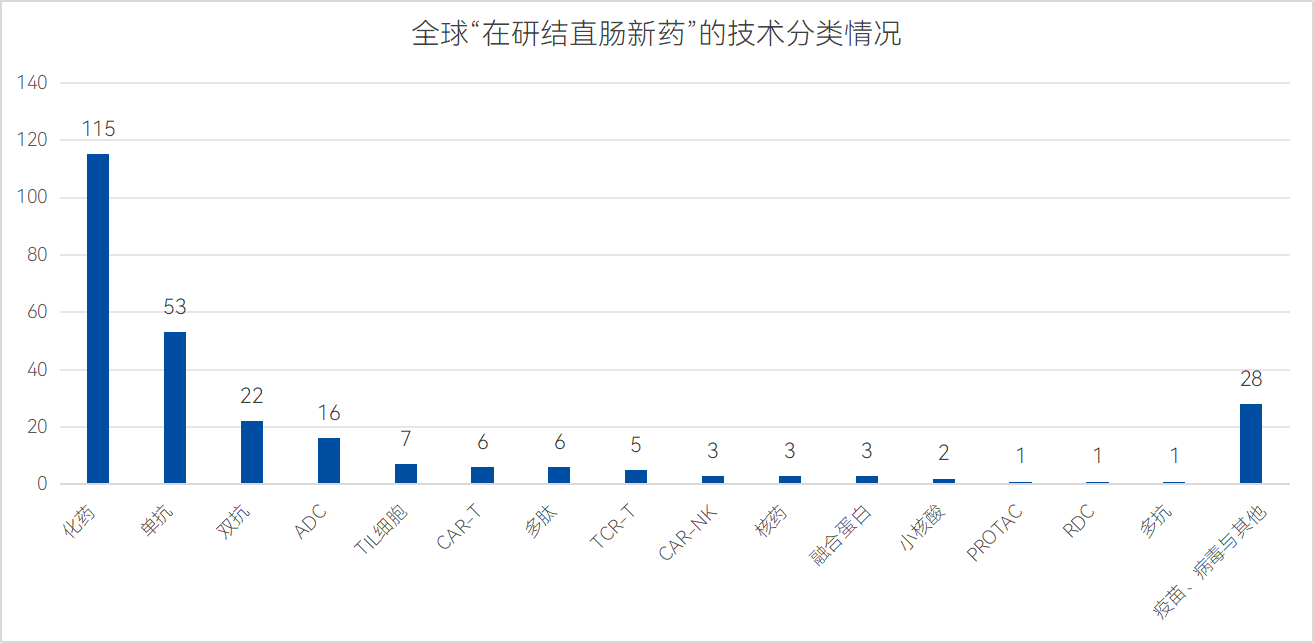
數據來源:藥智數據、藥智咨詢整理
其中,ADC作為近年來腫瘤治療領域蓬勃發展的重要領域,其通過將單克隆抗體與強效的細胞毒性藥物結合,有助于提升療效。是結直腸癌在研新藥中最被寄予厚望的技術方向。目前,全球尚無任何一款ADC產品獲批用于治療結直腸癌,僅有16款相關活躍ADC適應癥在研。
其中,除常規的HER2 ADC之外,CEACAM5 ADC與c-Met ADC是目前最被寄予厚望的ADC創新方向,有望在結直腸癌領域實現最終價值。
CEACAM5 ADC
CEACAM5屬于免疫球蛋白超家族黏附分子,且是CEA家族成員,通過其細胞外結構域參與細胞間的黏附,維持組織的結構和穩定,在腫瘤中通過癌細胞及間質、免疫細胞間相互作用參與腫瘤增殖、存活、轉移及免疫逃逸等多種發生、發展機制。
CEACAM5通常過表達于結直腸癌、胃癌、非小細胞肺癌、胰腺癌和卵巢癌以及人類胚胎和胎兒發育的早期階段(9~14周),而在成年人正常上皮細胞表達有限,可見于成熟腸上皮細胞頂端表面,但通常為弱/中表達,因此是結直腸癌的一個理想治療靶點。
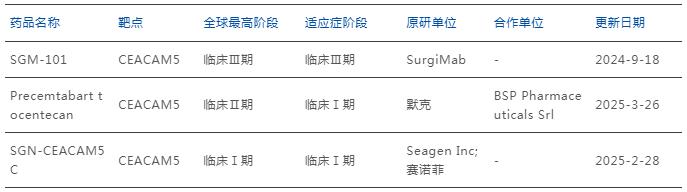
數據來源:藥智數據
目前,全球范圍內共有3款CEACAM5 ADC擁有結直腸癌適應癥在研,分別是SurgiMab的SGM-101、默克的M9140以及賽諾菲的PF-08046050,其中在2024年ASCO大會上,M9140首次公布了Ⅰ期劑量爬坡的臨床研究,中位PFS能夠達到6.7個月,遠遠超過標準三線藥物治療。
c-Met ADC
c-Met(MET蛋白)常過度表達于多種晚期實體瘤,但目前還沒有針對c-Met過表達結直腸癌的療法獲批。ABBV-400是一種新型靶向ADC,由c-Met抗體Telisotuzumab與新型拓撲異構酶1抑制劑有效載荷共軛而成。
目前,該領域全球范圍內僅有艾伯維的ABBV-400一款新藥明確擁有結直腸癌適應癥,其余20余款c-Met ADC的適應癥均集中于非小細胞肺癌、胃癌以及實體瘤層面。2024年ASCO大會上,該藥展示了來自結直腸癌的劑量ESC和擴增(EXP)隊列的數據,多項數據取得優勢。
而在系列新型療法中,TIL細胞、CAR-T、多肽等療法已有部分管線在臨床階段取得初步成效。
TIL療法中,其主要通過從腫瘤組織中分離出腫瘤浸潤的淋巴細胞,并在體外進行培養和擴增,然后回輸到患者體內以增強抗腫瘤免疫反應,其目前在結直腸癌上進展較快的代表管線有沙礫生物的GT307、Turnstone的TIDAL-01等。
CAR-T療法中,其主要從患者的血液中提取T細胞,并在體外對這些細胞進行基因改造,裝上識別癌細胞表面抗原的“嵌合抗原受體”(CAR)。然后經歷擴增、回輸之后,CAR-T細胞在患者體內一旦存活,將繼續繁殖,最終實現對癌細胞的攻擊。目前其主要應用于惡性血液腫瘤,但在GCC靶點被發現之后,該療法在結直腸癌領域也有了重要潛力,目前南京凱地生物的KD-025、Carina的CNA-3103在結直腸癌適應癥的臨床研究已進入了臨床II期間,領先全球。
PROTAC方面,其作為一種異雙功能分子,一端連接結合靶蛋白的配體,另一端連接E3連接酶的配體,中間通過合適的Linker相連。結構上與ADC有些類似,但其有效性卻并非靠細胞毒性藥物來完成,而是最終形成的三元復合物給靶蛋白打上泛素化的標簽,泛素化的蛋白被細胞內的蛋白酶體識別并降解。其腫瘤應用上,現階段主要針對非小細胞肺癌、前列腺癌、乳腺癌、血液腫瘤與部分自免疾病,其在結直腸癌領域的涉及較少,僅安斯泰來的ASP-3082一款新藥涉及,同時該藥還是全球首個且唯一進入臨床階段的KRAS G12D蛋白降解藥物,有望成為同類首創藥物。
總體而言,從結直腸癌目前技術趨勢上來看,一方面,隨著單抗逐漸走下神壇,生物靶向藥領域的ADC、雙抗正在逐漸走向前臺,雖目前這些創新技術領域在結直腸癌領域,無論是靶向方向還是臨床進度均還未取得階段性成果(如首款上市),但同質化新藥趨勢之下,兩者卻是企業宣傳差異化發展的不二之選,而借ADC理念、平臺及技術,未來也有望進一步精準升級藥物結構設計,使更多新型的抗體偶聯藥物有望開展研究并應用于結直腸癌的臨床治療。
靶點創新
成熟靶點優化+新靶點開拓同步進行
就靶點方向而言,作為目前結直腸癌精準治療的基本原則,目前領域內已有很多相對成熟的治療靶點,比如EGFR、VEGF、BRAF等,同時這類成熟靶點也是目前活躍在研管線中管線數量最多的存在。
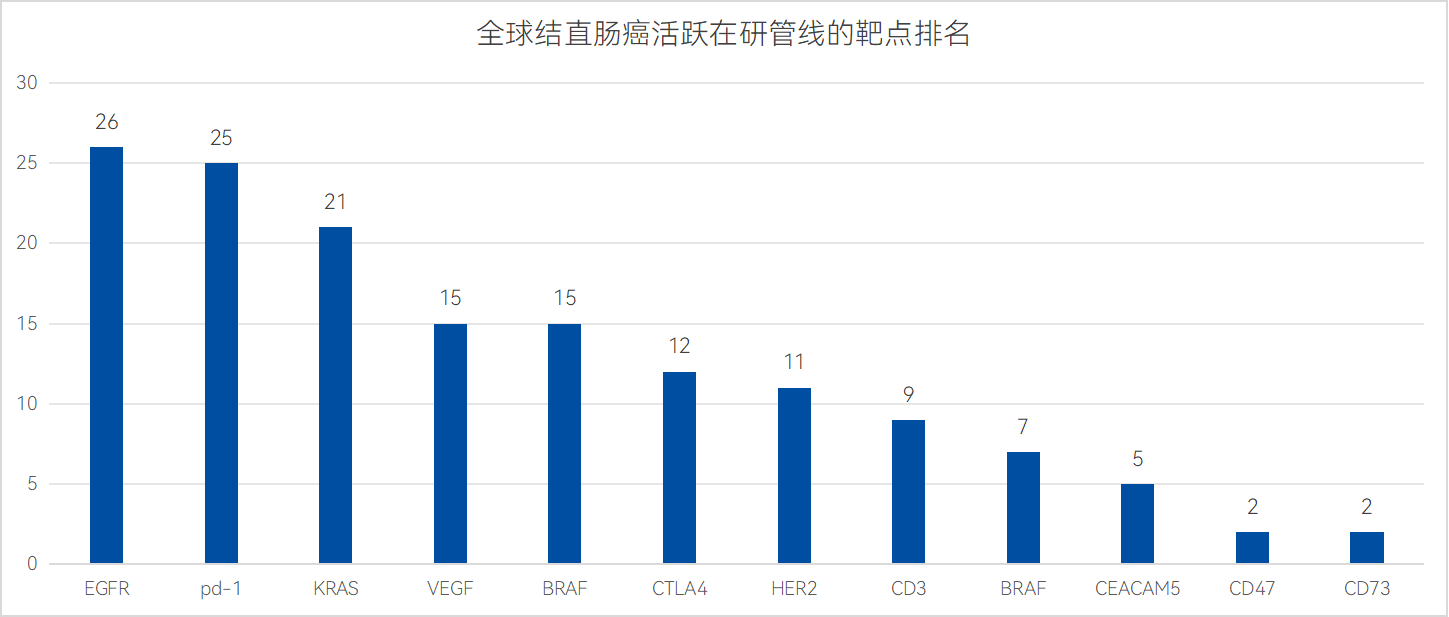
數據來源:藥智數據
數據顯示,271款活躍新藥管線中,EGFR靶點相關管線最多,共有26款活躍在研新藥涉及;其次是PD-1、KRAS、VEGF與BRAF等靶點方向,分別涉及25款、21款與15款新藥;最后,CTLA4、HER2、CD3等靶點也同樣有不少管線涉及。
目前,結直腸癌新藥在研圍繞靶點共有兩個主要優化方案,一者是通過對已成熟的靶點進行藥物改良優化組合策略;二者則是通過挖掘新的靶點,增加未來可用“武器”。
在成熟靶點優化上,由于結直腸癌是EGFR信號高度依賴的上皮性腫瘤,EGFR靶點可謂RAS/RAF野生型左半腸癌治療的基石藥物,因此優化在研療法中,以EGFR多樣化組合來推進創新療法進展的代表意義最顯著,例子有EGFR+MET、EGFR+CD28。
EGFR+MET:MET擴增是目前抗EGFR單抗的重要耐藥機制之一。因此EGFR/MET雙特異性抗體成為解決現有療法的潛力手段,目前強生的Amivantamab與岸邁生物的EMB-01是唯二涉及的管線。
數據來源:藥智數據
2024年ASCO大會上,Amivantamab的早期臨床研究結果公布,結果提示EGFR/MET雙抗在抗EGFR單抗經治/未經治的腸癌患者中均表現出較好的療效。
EGFR+CD28:MSS型結直腸癌是一類免疫耐藥的“冷腫瘤”,如何通過聯合治療腫瘤免疫微環境提高免疫治療獲益是長期以來的探索策略,EGFR+CD28的雙特異性抗體通過橋接EGFR表達的腫瘤細胞與T細胞并提供T細胞共刺激信號而發揮抗腫瘤效應。目前,該領域涉及企業不多,僅有再生元的REGN-7075與爍星生物SM-2275有所涉及,適應癥圍繞實體瘤進行。
數據來源:藥智數據
不過該領域目前進展程度不太理想,REGN7075的首次人體1/2期臨床研究中雖納入了部分結直腸癌患者,但其ORR僅為5.9%,DCR也僅達到29.4%,整體任重而道遠。
在新靶點挖掘上,目前針對某些特殊靶點突變類型,結直腸癌領域也迎來不少潛力靶點的在研,比如在mCRC患者中有12%的BRAF突變、有5%~7%比例的HER-2突變、超50%比例的KRAS突變。
BRAF突變:結直腸癌中的該突變與較短的總生存期相關,目前針對該靶點突變的結直腸癌,已有恩拉非尼與瑞戈非尼兩款新藥上市,國內外指南也將與其相關的雙藥化療或三藥化療列為一線治療方案。
數據來源:藥智數據
在一項評估西妥昔單抗+康奈非尼+比美替尼(EGFR單抗+BRAF+MEK)在mCRC患者二線或后線治療中的療效Ⅲ期BEACON研究中,其臨床結果可觀。各國指南也因此將其作為BRAF突變型mCRC的二線治療方案。
HER-2突變:該突變類型在mCRC患者占比約5%~7%,雖其市場雖較其他靶點較小,但同時其市場競爭也相對更寬裕,這對部分初創型Biotech尤為友好。
數據顯示,目前全球范圍內共有11款針對HER-2突變的活躍管線在研,其中基因泰克Pertuzumab與Trastuzumab的結直腸癌適應癥已成功獲批上市;默沙東Tucatinib也進入了注冊申請階段;恒瑞的SHR-A1811是現階段唯一一款針對結直腸癌的臨床Ⅲ期管線。
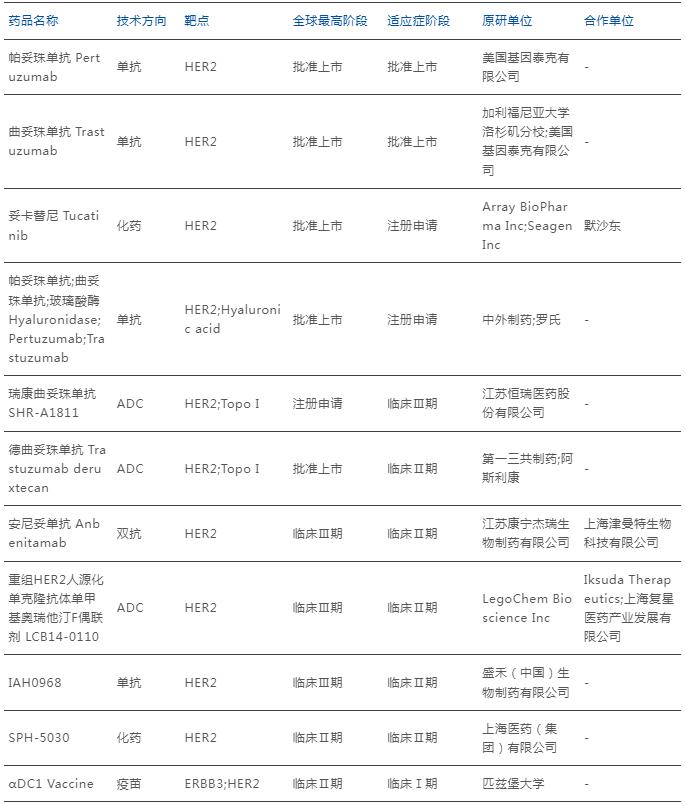
數據來源:藥智數據
在一項評估曲妥珠單抗+拉帕替尼治療難治性KRAS突變、HER-2過表達mCRC患者的療效的多中心開放標簽的Ⅱ期試驗中,療法獲得了30%的ORR,且中位PFS和OS分別達到5個月和11.5個月,基于該結果,曲妥珠單抗和拉帕替尼方案在2019年被納入NCCN指南。
同時,由于靶向HER-2 ADC技術現階段的熱度較高,對于該靶點結直腸癌療法中,也是ADC療法相對集中的靶點選擇,比如恒瑞醫藥的SHR-A1811、阿斯利康的DS-8201。
RAS突變:KRAS基因是多種實體腫瘤的重要驅動基因,從20世紀80年代被發現以來一直被認為是“不可成藥”靶點,直到KRAS G12C抑制劑的出現打破了這種困境。并且該靶點突變類型也是所有CRC患者中占比最高的存在,幾乎有一半的患者集中于此。細節上可分為KRAS G12C與KRAS G12D兩大類型。
針對KRAS G12C突變,目前全球領域已報道了多種KRAS G12C抑制劑聯合EGFR單抗在結直腸癌中的療效,總體上,客觀有效率在25%~45%,中位PFS為4.5~7.6個月。目前已知布局結直腸適應癥的新藥以安進的SOTORASIB(AMG 510)為主,第一個應用于臨床的KRAS G12C抑制劑,臨床結果效果顯著。而除此之外,二代KRAS G12C抑制劑Olomorasib、RMC-6291等適應癥為實體瘤的新藥,雖未被列入本次活躍管線中,但臨床試驗中也同樣涉及部分結直腸患者,且均表現出顯著的腫瘤抑制作用。
針對KRAS G12D突變,其相較KRAS G12C突變在消化系統腫瘤中發生率更高,但其同樣已有多個在研的KRAS G12D突變體特異性抑制劑,目前有臨床療效披露的是來自恒瑞公司的KRAS G12D的抑制劑HRS-4642。
初步臨床結果顯示,當前KRAS G12D抑制劑單藥治療在結直腸癌中療效受限,未來還需要探索聯合上游或下游的多靶點阻斷的治療模式。
結語:
多維度破局之路
就現如今的結直腸癌治療而言,其已然正在從單純的“延長生存”向“精準治愈”邁進,期間靶向治療所彰顯的優勢也正在被患者、醫務工作者與研發人員認可。
在技術方向方面,區別于傳統單抗療法,ADC、雙/多抗、CAR-T等新時代技術療法的加入,使得結直腸癌治療的領域迎來了更多治愈可能。
在免疫治療層面,雙免疫檢查點阻斷模式進步、免疫聯合靶向提高療效水平以及LAG-3抑制劑等新型免疫靶點的出現,極大地擴寬了免疫治療的受眾群體。
在靶點開拓層面,一方面傳統靶點在不斷優化中形成了以EGFR+MET、EGFR+CD28等為首的系列雙抗組合,另一方面RAS、HER2、BRAF與BRAF全新靶點的出現也給行業帶來更多差異化競爭的可能。
更關鍵的是,無論上述哪個層面,中國儼然已成為新時代結直腸癌新藥研發的重要力量,本土企業中如恒瑞醫藥(SHR-A1811、HRS-4642等)、信達生物(信迪利單抗、IBI310)、百利藥業(BL-B01D、BL-M17D1)康方生物(AK112、AK-104)等,其布局管線均能與全球頭部療法一較高下。
盡管結直腸癌新藥研發過程中挑戰重重,但靶向、免疫、細胞治療與新技術的融合,也必將借中國藥企之手,為患者帶來更多曙光。







