為全面反映2024年我國藥品不良反應監測情況,提高安全用藥水平,更好地保障公眾用藥安全,國家藥品不良反應監測中心組織編撰《國家藥品不良反應監測年度報告(2024年)》。
第1章 藥品不良反應監測工作情況
2024年,國家藥品不良反應監測中心在國家藥品監督管理局的領導下,深入貫徹落實黨中央、國務院決策部署,遵循“講政治、強監管、保安全、促發展、惠民生”的工作思路,堅持“科學評價為基礎、風險管理為主線、服務患者為中心”的警戒理念,以全面加強黨的建設工作為引領,持續鞏固藥物警戒根基,不斷提升技術支撐能力,積極開展警戒制度探索與交流合作,扎實推進藥物警戒生態建設,為藥品監管提供了強有力支撐,切實保護和促進公眾健康。
一是統籌協同,持續鞏固“一體兩翼”格局。探索開展國家和省級中心一體化監測評價協作平臺試點工作,開展各級藥品不良反應監測機構技術人員業務培訓、藥品不良反應監測哨點培訓、醫療機構培訓、藥品上市許可持有人(以下簡稱“持有人”)及經營企業培訓等,促進藥品不良反應監測能力提升。開展持有人藥物警戒檢查,不斷壓實藥物警戒主體責任。
二是制度引領,穩步健全法規制度體系。持續推進《藥品不良反應報告和監測管理辦法》修訂相關工作。研究起草《藥品上市后安全性評價技術指導原則》《藥品上市后風險溝通技術指導原則》《真實世界數據支持藥品安全性主動監測的一般原則》等技術指南和規范性文件,指導持有人開展藥物警戒工作,推動藥物警戒制度建立健全。
三是風險防范,不斷提升技術支撐能力。完成顛茄磺芐啶片、元胡止痛制劑、人血白蛋白等藥品安全性評價,根據評價結果,國家藥監局發布藥品說明書修訂公告33期、注銷藥品注冊證書公告1期。開展藥品預警信號審核,有效防控風險隱患,更好地保障公眾用藥安全。
四是開放合作,深度參與國際監管實踐。作為世界衛生組織國際藥物監測項目成員國,中國切實履行職責,與烏普薩拉監測中心建立信息交流和技術交流常態化機制,定期共享不良反應數據。參加人用藥品技術要求國際協調理事會(ICH)、國際藥品監管機構聯盟(ICMRA)相關國際工作組會議,啟動全球同步的ICH E2D(R1)指導原則監管機構征求意見程序,參與ICH M1的《MedDRA考慮要點伴隨文件》等指南修訂完善及發布。
五是共治共享,協同構建社會共治局面。發布《藥物警戒快訊》12期,開展“全國藥品安全宣傳周-攜手共建藥品安全防線”活動,以中心網站、“中國藥物警戒”微信公眾號為平臺,持續宣傳安全用藥知識,指導公眾正確認識不良反應。
第2章 藥品不良反應/事件報告情況
2.1 報告總體情況
2.1.1 2024年度藥品不良反應/事件報告情況
2024年全國藥品不良反應監測網絡收到《藥品不良反應/事件報告表》259.7萬份。1999年至2024年,全國藥品不良反應監測網絡累計收到《藥品不良反應/事件報告表》2,587.2萬份(圖1)。
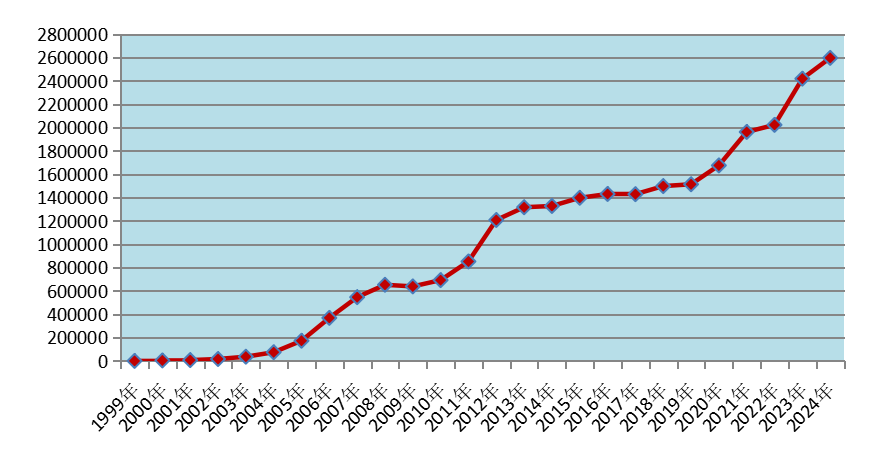
圖1 1999年-2024年全國藥品不良反應/事件報告數量增長趨勢
2.1.2 新的和嚴重藥品不良反應/事件報告情況
2024年全國藥品不良反應監測網絡收到新的和嚴重藥品不良反應/事件報告90.9萬份;新的和嚴重藥品不良反應/事件報告占同期報告總數的35.0%。
2024年全國藥品不良反應監測網絡收到嚴重藥品不良反應/事件報告45.4萬份,嚴重藥品不良反應/事件報告占同期報告總數的17.5%(圖2)。
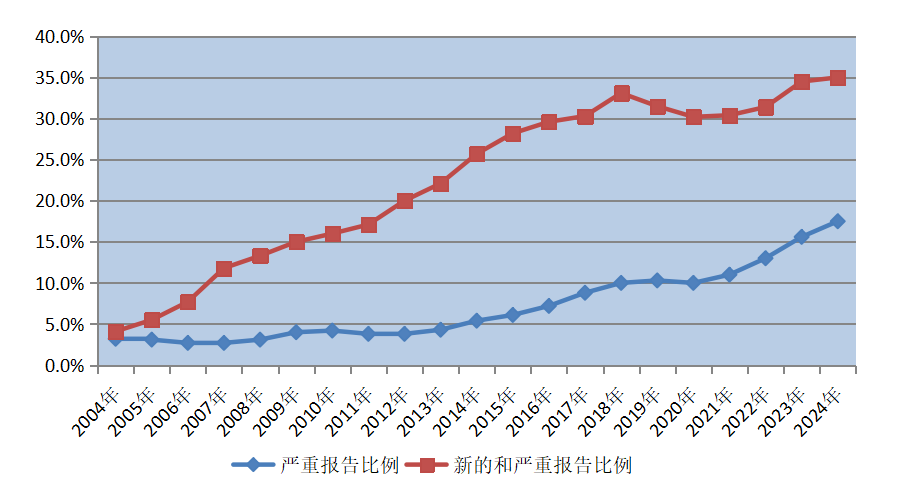
圖2 2004年-2024年新的和嚴重以及嚴重藥品不良反應/事件報告比例
小貼士:
如何正確認識藥品不良反應報告?
藥品不良反應是指合格藥品在正常用法用量下出現的與用藥目的無關的有害反應。藥品不良反應是藥品的固有屬性,一般來說,所有藥品都會存在或多或少、或輕或重的不良反應。
藥品不良反應監測是藥品上市后安全監管的重要支撐,其目的是及時發現和控制藥品安全風險。持有人、經營企業、醫療機構應當報告所發現的藥品不良反應,國家鼓勵公民、法人和其他組織報告藥品不良反應。
經過各方努力,持有人、經營企業、醫療機構報告藥品不良反應的積極性已經逐步提高,我國藥品不良反應報告數量穩步增長,與歐盟、美國等國家和地區藥品不良反應報告數量發展趨勢相同。嚴重藥品不良反應/事件報告比例是衡量報告總體質量和可利用性的重要指標之一,藥品不良反應監測評價工作一直將收集和評價新的和嚴重藥品不良反應作為重點內容。新的和嚴重藥品不良反應報告,尤其是嚴重藥品不良反應報告數量增多,并非說明藥品安全水平下降,而是意味著監管部門掌握的信息越來越全面,對藥品的風險更了解,風險更可控,對藥品的評價更加有依據,監管決策更加準確。同樣,在醫療實踐中,能及時了解藥品不良反應發生的表現、程度,并最大限度地加以避免和科學處置,也是保證患者用藥安全的重要措施。
2.1.3 每百萬人口平均報告情況
每百萬人口平均報告數量是衡量一個國家藥品不良反應監測工作水平的重要指標之一。2024年我國每百萬人口平均報告數為1,842份。
2.1.4 藥品不良反應/事件縣級報告比例
藥品不良反應/事件縣級報告比例是衡量我國藥品不良反應監測工作均衡發展及覆蓋程度的重要指標之一。2024年全國98.7%的縣級地區報告了藥品不良反應/事件。
2.1.5 報告來源情況
持有人、經營企業和醫療機構是藥品不良反應報告的責任單位。按照報告來源統計,2024年來自醫療機構的報告占91.2%、來自經營企業的報告占5.0%、來自持有人的報告占3.7%、來自其他報告者的報告占0.1%(圖3)。

圖3 2024年藥品不良反應/事件報告來源
按照報告數量統計,2024年持有人報送藥品不良反應/事件報告共計95,052份,同比增長11.5%。其中,新的和嚴重藥品不良反應/事件報告占持有人報告總數的53.7%。
2.1.6 報告人職業
按照報告人職業統計,醫生占57.1%、藥師占24.9%、護士占12.2%、其他職業占5.8%(圖4)。
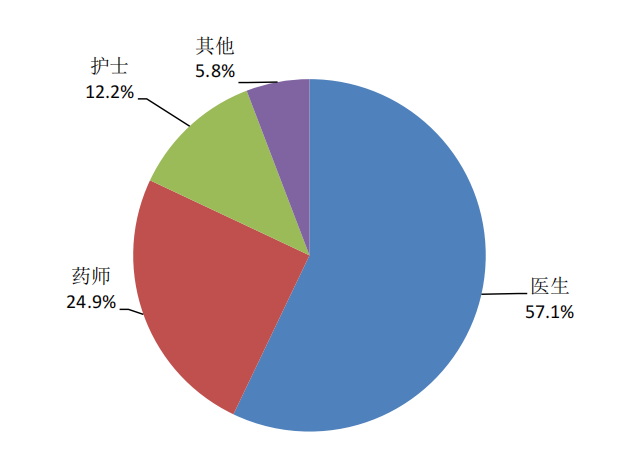
圖4 2024年報告人職業構成
2.1.7 涉及患者情況
2024年藥品不良反應/事件報告中,男女性別比為0.83:1。從年齡分布看,14歲及以下兒童患者占8.7%,65歲及以上老年患者占33.4%(圖5)。
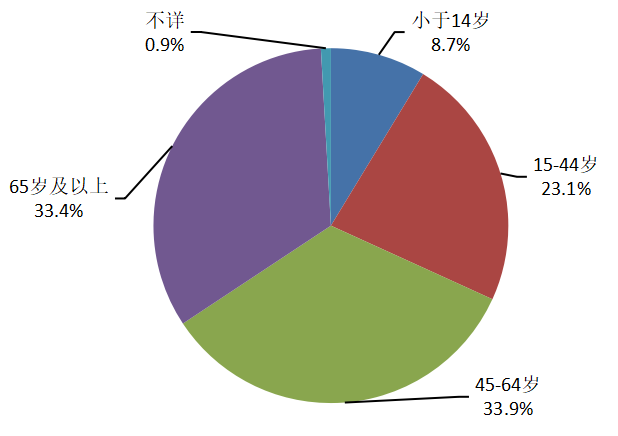
圖5 2024年藥品不良反應/事件報告涉及患者年齡
2.1.8 涉及藥品情況
按照懷疑藥品類別統計,化學藥品占81.0%、中藥占12.1%、生物制品占3.9%、無法分類占3.0%(圖6)。
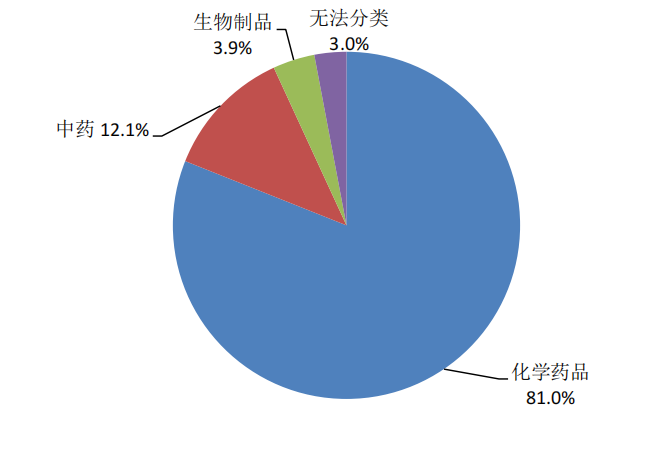
圖6 2024年藥品不良反應/事件報告涉及藥品類別
按照給藥途徑統計,2024年藥品不良反應/事件報告中,注射給藥占57.2%、口服給藥占33.1%、其他給藥途徑占9.7%;注射給藥中,靜脈注射給藥占91.0%、其他注射給藥占9.0%(圖7)。
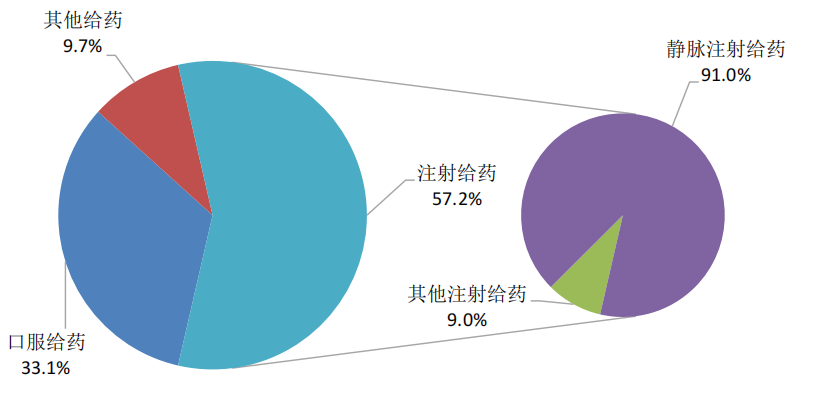
圖7 2024年藥品不良反應/事件報告涉及給藥途徑
2.1.9 累及器官系統情況
2024年報告的藥品不良反應/事件中,累及器官系統排名前3位依次為皮膚及皮下組織類疾病、胃腸系統疾病、血管與淋巴管類疾病(圖8)。
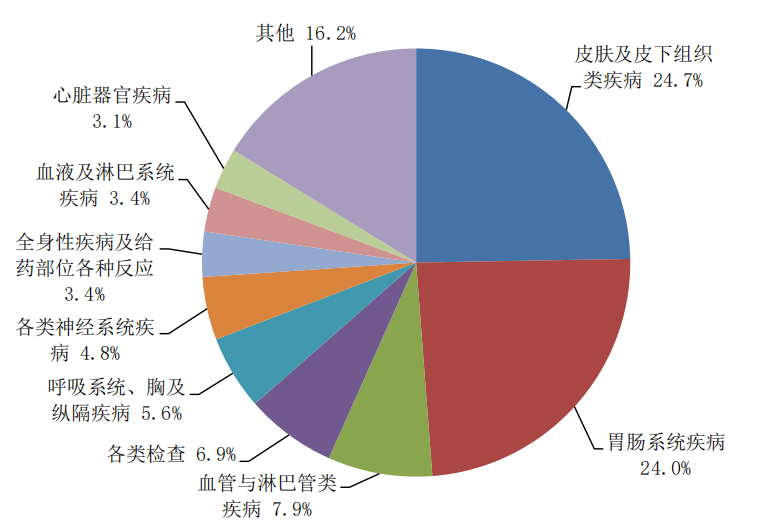
圖8 2024年藥品不良反應/事件累及器官系統
2.2 化學藥品監測情況
2.2.1 總體情況
2024年藥品不良反應/事件報告中,涉及懷疑藥品286.6萬例次,其中化學藥品占81.0%。2024年嚴重不良反應/事件報告涉及懷疑藥品58.4萬例次,其中化學藥品占84.2%。
2.2.2 涉及患者情況
2024年化學藥品不良反應/事件報告中,男女性別比為0.83:1。14歲及以下兒童患者占9.1%,65歲及以上老年患者占33.7%。
2.2.3 涉及藥品情況
2024年藥品不良反應/事件報告涉及的化學藥品中,例次數排名前5位的類別依次為抗感染藥、腫瘤用藥、心血管系統用藥、鎮痛藥、神經系統用藥。2024年嚴重藥品不良反應/事件涉及化學藥品中,報告數量最多的為腫瘤用藥,占32.8%;其次是抗感染藥,占30.8%。
按劑型統計,2024年化學藥品不良反應/事件報告中,注射劑、口服制劑所占比例分別為62.7%和31.9%,其他劑型占5.4%。
2.2.4 總體情況分析
2024年化學藥品不良反應/事件報告情況與2023年相比未出現顯著變化,安全形勢總體平穩可控。從不良反應涉及患者年齡看,應持續加強14歲及以下兒童、65歲及以上老年患者的安全用藥管理。從化學藥品類別上看,抗感染藥報告數量仍居于首位,其占比呈現小幅上升,考慮與2024年該類藥品的使用量有關。抗感染藥的品種中排名前5位的藥品與2023年無變化,左氧氟沙星仍位居首位。化學藥品排名前20位的品種中,碘克沙醇為新增品種。
小貼士:
碘克沙醇注射液使用時應注意什么?
碘克沙醇是一非離子型、雙體、六碘、水溶性的X線對比劑,臨床用于心血管、腦血管、外周動脈、腹部血管、尿路、靜脈造影以及CT增強檢查。碘克沙醇可引起類過敏反應或超敏反應。超敏反應可能包括嚴重的、危及生命的速發嚴重過敏反應/類過敏反應,主要表現為呼吸系統或皮膚癥狀,如呼吸困難、皮疹、紅斑、蕁麻疹、瘙癢、重度皮膚反應、血管神經性水腫、低血壓、發熱、喉水腫、支氣管痙攣或肺水腫等。超敏反應可能與劑量和給藥方式無關的情況下發生,使用時需注意:1.對碘對比劑有過敏、哮喘病史的患者需要特別謹慎。2.大多數嚴重副作用出現在注射藥物后的前30分鐘內,應備好必要的藥物和設備以便發生嚴重反應時立即救治。3.在整個X線操作中使用留置管或導管以保持靜脈輸液通路通暢。4.本品給藥后應當對患者進行觀察至少30分鐘。
2.3 中藥監測情況
2.3.1 總體情況
2024年藥品不良反應/事件報告中,涉及懷疑藥品286.6萬例次,其中中藥占12.1%;2024年嚴重不良反應/事件報告涉及懷疑藥品58.4萬例次,其中中藥占5.1%。
2.3.2 涉及患者情況
2024年中藥不良反應/事件報告中,男女性別比為0.77:1。14歲及以下兒童患者占6.3%,65歲及以上老年患者占31.5%。
2.3.3 涉及藥品情況
2024年藥品不良反應/事件報告涉及的中藥中,例次數排名前5位的類別分別是理血劑中活血化瘀藥、清熱劑中清熱解毒藥、祛濕劑中清熱除濕藥、補益劑中益氣養陰藥、祛濕劑中祛風勝濕藥。2024年中藥嚴重不良反應/事件報告中,例次數排名前5位的類別分別是理血劑中活血化瘀藥、清熱劑中清熱解毒藥、補益劑中益氣養陰藥、開竅劑中涼開藥、補益劑中補陽藥。
2024年中藥不良反應/事件報告中,注射劑和口服制劑所占比例分別為24.6%和64.0%。
2.3.4 總體情況分析
與2023年相比,2024年中藥不良反應/事件報告數略有增加,嚴重不良反應/事件報告占比為8.3%,低于總體藥品不良反應/事件報告中嚴重不良反應/事件報告占比。從藥品類別上看,活血化瘀藥的報告數量依然居首位,占比略有上升。從總體情況看,2024年中藥占總體不良反應/事件報告比例呈下降趨勢,但仍需要注意安全用藥。
小貼士:
如何看待中藥的不良反應?
“是藥三分毒”,中藥和其他藥品一樣,在發揮治療作用的同時,也可能會產生不良反應。辨證論治是中醫認識疾病和治療疾病的基本原則,嚴格按照說明書規定的功能主治使用中藥,有助于減少和避免不良反應/事件的發生。如果不遵循中醫辨證論治的原則或者辨證不當、超說明書功能主治用藥,可能增加中藥不良反應/事件發生風險。隨著中藥臨床使用日趨廣泛,應提高中藥安全使用的意識。
2.4 生物制品監測情況
2.4.1 總體情況
2024年藥品不良反應/事件報告中,涉及懷疑藥品286.6萬例次,其中生物制品占3.9%。2024年嚴重不良反應/事件報告涉及懷疑藥品58.4萬例次,其中生物制品占6.7%。
2.4.2 涉及患者情況
2024年生物制品不良反應/事件報告中,男女性別比為1.15:1。14歲及以下兒童患者占7.4%、15-44歲年齡組占15.4%、45-64歲年齡組占37.5%、65歲及以上老年患者占32.9%、不詳占6.8%;其中排名第1位的為45-64歲年齡組。
2.4.3 涉及藥品情況
2024年藥品不良反應/事件報告涉及的生物制品中,例次數排名前5位的類別依次為抗腫瘤藥和免疫機能調節藥、消化道及代謝用藥、系統用抗感染藥、血液和造血器官用藥、非性激素和胰島素類的激素類系統用藥。2024年嚴重藥品不良反應/事件涉及生物制品中,報告數量最多的為抗腫瘤藥和免疫機能調節藥,占78.2%;其次是消化道及代謝用藥,占7.7%。
按劑型統計,2024年生物制品不良反應/事件報告中,注射劑、口服制劑所占比例分別為75.6%和1.4%,其他劑型(含不詳)占23.0%。
2.4.4 報告來源情況
2024年生物制品不良反應/事件報告中,醫療機構報告占76.2%、持有人報告占23.4%、經營企業和其他機構報告占0.4%。嚴重報告中,醫療機構報告占80.3%、持有人報告占19.6%、經營企業和其他機構報告占0.1%。
2.4.5 總體情況分析
2024年生物制品不良反應/事件報告中,從涉及患者年齡看,14歲及以下兒童患者和65歲及以上老年患者占比同藥品總體不良反應的情況基本一致。從生物制品類別上看,抗腫瘤藥和免疫機能調節藥居于首位,排名前5位的藥品以單克隆抗體類抗腫瘤藥居多。從報告來源上看,來自持有人報告占生物制品報告總數的23.4%,高于總體報告中持有人報告的占比。
小貼士:
什么是生物制品?
依據《中國藥典》(2020年版),生物制品是指以微生物、細胞、動物或人源組織和體液等為起始原材料,用生物學技術制成,用于預防、治療和診斷人類疾病的制劑。
2.5 基本藥物監測情況
2.5.1 國家基本藥物監測總體情況
2024年全國藥品不良反應監測網絡共收到《國家基本藥物目錄(2018年版)》收載品種的不良反應/事件報告116.6萬份,其中嚴重報告22.3萬份,占19.1%。報告涉及化學藥品和生物制品占87.9%,中成藥占12.1%。
2.5.2 國家基本藥物化學藥品和生物制品情況分析
《國家基本藥物目錄(2018年版)》化學藥品和生物制品部分共417個(類)品種。2024年全國藥品不良反應監測網絡共收到國家基本藥物化學藥品和生物制品藥品不良反應/事件報告111.0萬例次,其中嚴重報告25.4萬例次,占22.9%。
2024年國家基本藥物化學藥品和生物制品不良反應/事件報告按照藥品類別統計,報告數量排名前5位的分別是抗微生物藥、抗腫瘤藥、心血管系統用藥、激素及影響內分泌藥、治療精神障礙藥;累及器官系統排名前5位的是皮膚及皮下組織類疾病、胃腸系統疾病、血管與淋巴管類疾病、各類檢查及各類神經系統疾病。
2.5.3 國家基本藥物中成藥情況分析
《國家基本藥物目錄(2018年版)》中成藥共涉及268個(類)品種。2024年全國藥品不良反應監測網絡共收到國家基本藥物中成藥不良反應/事件報告15.2萬例次,其中嚴重報告13,635例次,占9.0%。2024年國家基本藥物7大類中成藥中,藥品不良反應/事件報告總數由多到少依次為內科用藥、骨傷科用藥、婦科用藥、耳鼻喉科用藥、外科用藥、兒科用藥、眼科用藥。
監測數據表明,2024年國家基本藥物監測總體情況基本保持平穩。
小貼士:
《國家基本藥物目錄(2018年版)》收錄品種情況
2018年11月1日起,我國正式啟用《國家基本藥物目錄(2018年版)》。該目錄主要分為化學藥品和生物制品、中成藥和中藥飲片三個部分。其中化學藥品和生物制品部分包括抗微生物藥、抗寄生蟲病藥等26類藥品,中成藥部分包括內科用藥、外科用藥、婦科用藥等7類藥品,目錄總品種數量為685種,其中西藥417種、中成藥268種。
第3章 相關風險控制措施
根據2024年藥品不良反應監測數據和分析評價結果,國家藥品監督管理局對發現存在安全隱患的藥品及時采取相應風險控制措施,以保障公眾用藥安全。
發布氨甲環酸注射制劑、元胡止痛制劑、破傷風人免疫球蛋白等藥品說明書修訂公告共33期,增加或完善39個(類)品種說明書中的警示語、不良反應、注意事項、禁忌等安全性信息。發布《國家藥監局關于注銷顛茄磺芐啶片藥品注冊證書的公告》。
發布《藥物警戒快訊》12期,報道國外藥品安全信息53條。
第4章 各論
根據藥品不良反應監測結果以及公眾關注情況,對抗感染藥、心血管系統用藥、兒童用藥、生物制品抗腫瘤藥、女性生殖系統用藥不良反應監測情況進行分析,并提示安全風險如下。
4.1 抗感染藥不良反應監測情況
本報告中的抗感染藥是指具有殺滅或抑制各種病原微生物作用的化學藥品,包括抗生素、合成抗菌藥、抗真菌藥、抗病毒藥等,是臨床應用最為廣泛的藥品類別之一,其不良反應/事件報告數量一直居于首位,是藥品不良反應監測工作關注的重點。
2024年全國藥品不良反應監測網絡共收到抗感染藥不良反應/事件報告80.0萬份,其中嚴重報告14.0萬份,占17.5%。抗感染藥不良反應/事件報告數量占2024年總體報告數量的30.8%。
4.1.1 涉及藥品情況
2024年抗感染藥不良反應/事件報告數量排名前3位的藥品類別分別是喹諾酮類、頭孢菌素類、大環內酯類,嚴重不良反應/事件報告數量排名前3位的藥品類別分別是頭孢菌素類、喹諾酮類、青霉素類。
2024年抗感染藥不良反應/事件報告中,注射劑占79.6%、口服制劑占17.6%、其他劑型占2.8%,與藥品總體報告劑型分布相比注射劑比例偏高;嚴重不良反應/事件報告中,注射劑占80.9%、口服制劑占17.8%、其他劑型占1.3%。
4.1.2 累及器官系統情況
2024年抗感染藥不良反應/事件報告中,總體報告和嚴重報告的藥品不良反應/事件累及器官系統情況詳見圖9。與抗感染藥的總體報告相比,嚴重報告的血管與淋巴管類疾病,呼吸系統、胸及縱隔疾病,各類檢查,心臟器官疾病構成比偏高。
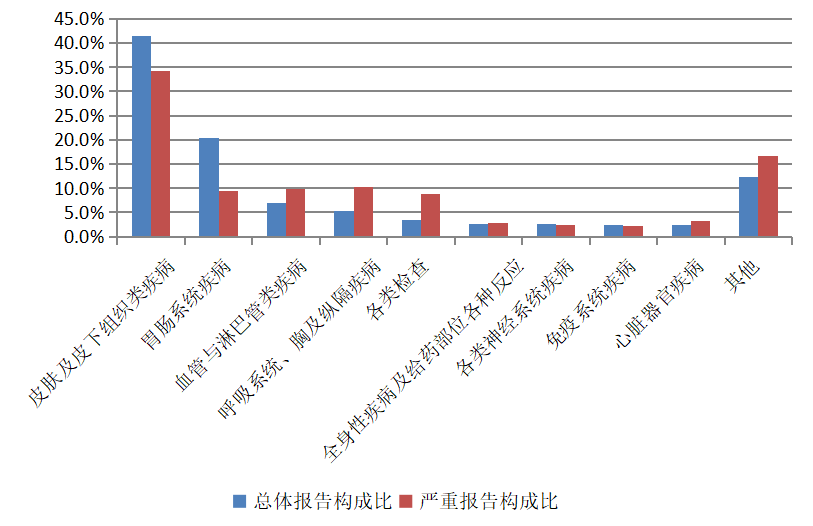
圖9 2024年抗感染藥不良反應/事件累及器官系統
抗感染藥不良反應/事件報告中,口服制劑累及器官系統的前5位是胃腸系統疾病、皮膚及皮下組織類疾病、各類檢查、血管與淋巴管類疾病、精神病類;注射劑累及器官系統前5位是皮膚及皮下組織類疾病,胃腸系統疾病,血管與淋巴管類疾病,呼吸系統、胸及縱隔疾病,各類檢查。
抗感染藥嚴重藥品不良反應/事件報告中,口服制劑累及器官系統排名前5位的皮膚及皮下組織類疾病、各類檢查、肝膽系統疾病、胃腸系統疾病、代謝及營養類疾病;注射劑累及器官系統排名前5位的是皮膚及皮下組織類疾病,呼吸系統、胸及縱隔疾病,血管與淋巴管類疾病,胃腸系統疾病,各類檢查。
4.1.3 監測情況分析及安全風險提示
2024年抗感染藥不良反應/事件報告占總體報告比例仍然居高不下,總體不良反應報告數量和嚴重不良反應報告數量均出現了較高的增長,但與總體報告不良反應/事件的增長趨勢基本一致,提示抗感染藥的用藥風險仍需繼續關注。
小貼士:
美洛西林鈉使用時應注意些什么?
美洛西林是苯咪唑青霉素類抗生素,臨床用于各種厭氧菌感染的治療。接受美洛西林鈉治療的患者有發生嚴重不良反應的風險,包括過敏性休克、粒細胞缺乏癥、中樞神經系統癥狀、嚴重皮膚過敏反應等。美洛西林鈉不宜與其他藥品配伍使用,與其他藥品序貫使用時應更換輸液器。大劑量靜脈給予美洛西林鈉或有嚴重腎功能不全的患者,可能會引起神經毒性反應,包括反射亢進、肌陣攣性抽搐、驚厥和昏迷;且與出血時間延長、紫癜和黏膜出血相關的血小板功能障礙主要發生在腎功能受損的患者中。患者接受該藥物治療時,應監測腎功能選擇合理的劑量,腎功能減退患者應適當降低用量;若臨床上發生出血,且出血的其他原因不明時,必須停用本藥。因本品含鈉的影響,大劑量美洛西林鈉可出現高鈉血癥、低鉀血癥等,嚴重電解質紊亂的患者使用本品時,使用保鉀利尿藥可能會有所幫助。長期大劑量治療的患者,應監測電解質平衡、造血功能和腎功能。
4.2 心血管系統用藥不良反應監測情況
本報告中的心血管系統用藥是指用于心臟疾病治療、血管保護、血壓和血脂調節的化學藥品,包括降血壓藥、抗心絞痛藥、血管活性藥、抗動脈粥樣硬化藥、抗心律失常藥、強心藥、其他心血管系統藥等。
2024年全國藥品不良反應監測網絡共收到心血管系統用藥的不良反應/事件報告18.8萬份,占總體報告的7.2%;其中嚴重報告20,602份,占心血管系統用藥的11.0%。
4.2.1 涉及患者情況
2024年心血管系統用藥不良反應/事件報告中,女性患者比男性患者高4.0個百分點;嚴重報告中,男性患者比女性患者高1.5個百分點。
2024年心血管系統用藥不良反應/事件報告中,45-64歲與65歲及以上年齡組分別占40.2%和50.2%,遠高于其他年齡組比例;嚴重報告中,65歲及以上年齡組占54.5%。
4.2.2 涉及藥品情況
2024年心血管系統用藥不良反應/事件報告數量排名前3位的藥品類別是降血壓藥、抗心絞痛藥、血管活性藥;心血管系統用藥嚴重報告數量排名前3位的藥品類別是抗動脈粥樣硬化藥、降血壓藥、血管活性藥。
2024年心血管系統用藥不良反應/事件報告中,注射劑占30.4%、口服制劑占68.0%、其他劑型占1.6%;嚴重報告中,注射劑占39.7%、口服制劑占58.2%、其他劑型占2.1%。
4.2.3 累及器官系統情況
2024年心血管系統用藥不良反應/事件報告中,總體報告和嚴重報告的藥品不良反應/事件累及器官系統情況詳見圖10。2024年心血管系統用藥不良反應/事件報告中,口服制劑累及器官系統排名前5位是胃腸系統疾病、各類神經系統疾病、血管與淋巴管類疾病、皮膚及皮下組織類疾病、代謝及營養類疾病;注射劑累及器官系統前5位是胃腸系統疾病、各類神經系統疾病、血管與淋巴管類疾病、皮膚及皮下組織類疾病、心臟器官疾病。
2024年心血管系統用藥嚴重不良反應/事件報告中,口服制劑累及器官系統排名前5位的是各類檢查、肝膽系統疾病、皮膚及皮下組織類疾病、血管與淋巴管類疾病、代謝及營養類疾病;注射劑累及器官系統排名前5位的是呼吸系統、胸及縱隔疾病,血管與淋巴管類疾病,皮膚及皮下組織類疾病,心臟器官疾病,胃腸系統疾病。
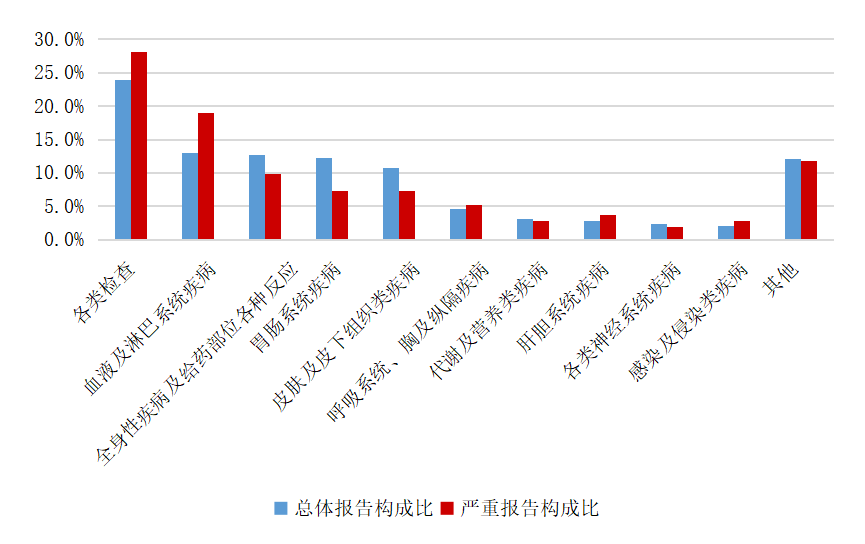
圖10 2024年心血管系統用藥不良反應/事件累及器官系統
4.2.4 監測情況分析及安全風險提示
2024年心血管系統用藥不良反應/事件報告中,降血壓藥為報告數最多的心血管類藥物,這與高血壓的治療藥物種類較多有關,還與高血壓的發病率較高、用藥人群基數大相關。嚴重不良反應/事件報告中,抗動脈粥樣硬化藥的報告構成比排名第一,其中阿托伐他汀報告的數量最多;不良反應表現最多的為肝功能異常、轉氨酶升高、肝損傷等,提示醫務人員和患者應關注這類藥物的肝損害風險。
小貼士 :
抗心絞痛藥有哪些?常見不良反應有哪些?使用中應注意什么?
抗心絞痛藥主要分為硝酸酯類、鈣通道阻滯劑、β受體阻滯劑及其他抗心絞痛藥等,包括的常用藥物有單硝酸異山梨酯、硝酸異山梨酯、硝苯地平、美托洛爾等。
抗心絞痛藥常見不良反應主要表現為頭痛、頭暈、潮紅、惡心、嘔吐、心悸、外周水腫、皮疹、瘙癢、胸部不適、低血壓等。患者在使用此類藥品前應仔細閱讀藥品說明書不良反應、注意事項、警示、禁忌等安全性提示信息,服用藥品期間如出現不適,及時就醫;此外,抗心絞痛藥常常和其他藥品聯合使用,需要特別關注藥物相互作用。
4.3 兒童用藥監測情況
2024年全國藥品不良反應監測網絡共收到14歲及以下兒童患者報告占總報告數8.7%。兒童患者嚴重報告占兒童患者總報告數15.8%。
4.3.1 涉及患者情況
2024年兒童患者藥品不良反應/事件報告中,男女性別比為1.24:1。2024年兒童患者藥品不良反應/事件報告年齡分組情況見圖11。
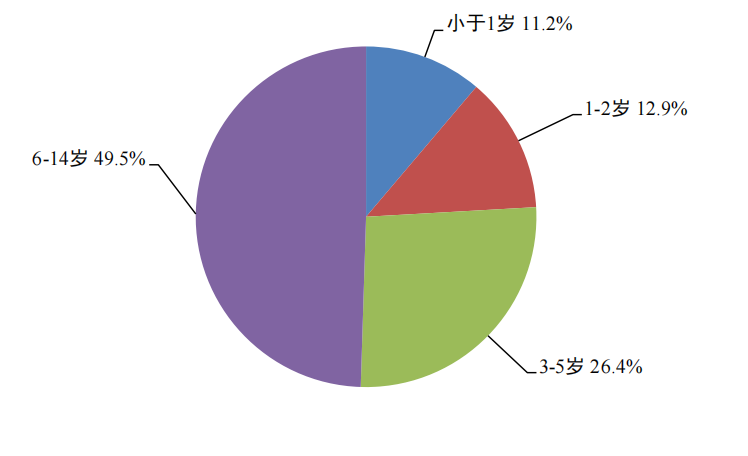
圖11 2024年兒童患者藥品不良反應/事件報告涉及兒童患者年齡
4.3.2 涉及藥品情況
按照藥品類別統計,化學藥品占87.8%、中藥占9.2%、生物制品占3.0%。化學藥品排名前5位的是抗感染藥,電解質、酸堿平衡及營養藥,呼吸系統用藥,代謝及內分泌系統用藥,鎮痛藥。中藥排名前5位的是清熱劑、解表劑、止咳平喘劑、祛痰劑、消食劑。
2024年兒童藥品不良反應/事件報告中,注射劑占72.1%,口服制劑占21.1%,其他制劑占6.8%。化學藥品不良反應/事件報告中,注射劑、口服制劑所占比例分別為76.9%和15.9%。中藥不良反應/事件報告中,注射劑、口服制劑所占比例分別為26.0%和70.5%。
4.3.3 累及器官系統情況
2024年兒童藥品不良反應/事件報告中,累及系統排名前3位的是皮膚及皮下組織類疾病、胃腸系統疾病、血管與淋巴管類疾病(圖12)。化學藥品累及系統排名前3位的是皮膚及皮下組織類疾病、胃腸系統疾病、血管與淋巴管類疾病,排名與總體一致。中藥累及系統排名前3位的是胃腸系統疾病、皮膚及皮下組織類疾病、全身性疾病及給藥部位各種反應。
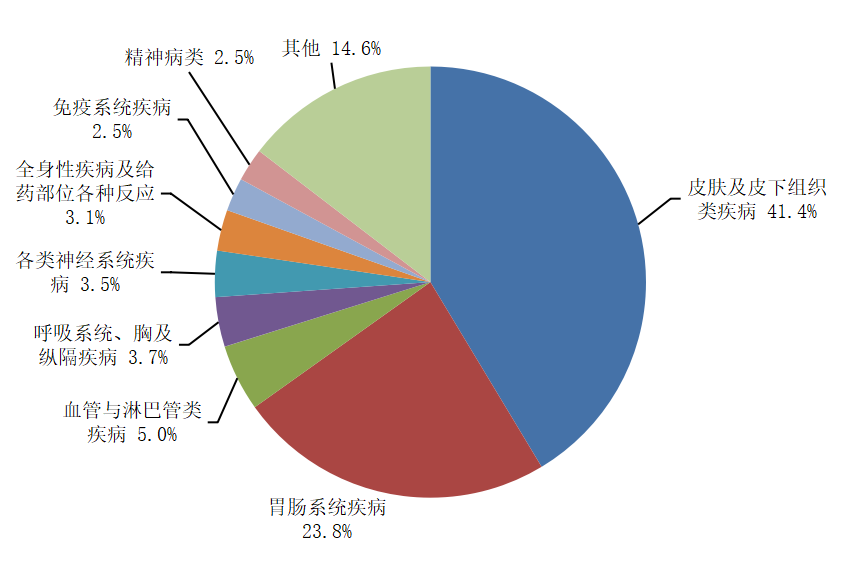
圖12 2024年兒童患者藥品不良反應/事件累及器官系統
4.3.4 監測情況分析及安全風險提示
2024年兒童患者藥品不良反應/事件報告占報告總數的8.7%,嚴重報告占比(15.8%)低于總體情況(17.5%)。藥物治療是兒童防病治病的主要手段,因兒童生長期的生理特點,對藥物具有特殊的反應性和敏感性,因此應持續關注兒童人群用藥安全。
2024年統計數據顯示,兒童患者用藥在藥品類別分布上,化學藥品與2023年相同,抗感染藥,電解質、酸堿平衡及營養藥,呼吸系統用藥的構成比高于該類別藥品在化學藥品總體報告中的構成比;中藥排名居前的藥品類別為清熱劑、解表劑、止咳平喘劑、祛痰劑,這可能與兒童患者疾病譜使用以上藥品較多及生理特點有關。
小貼士:
如何確保兒童用藥劑量準確?
確保兒童用藥劑量準確是保障孩子用藥安全的關鍵環節。兒童的身體機能尚未發育完全,對藥物的代謝和耐受能力與成人存在顯著差異,因此不能簡單地將成人藥物減量給孩子使用。兒童用藥劑量的計算方法有多種,其中最常用的是基于體重計算。此外,有些藥物可以根據年齡分段進行調整。對于需要更精確劑量的藥物,還可以根據體表面積來計算,這種方法相對更科學,能夠更精準地滿足個體差異。
優先選擇兒童專用劑型非常重要。兒童專用藥物在成分、劑量和劑型上更適合兒童,例如糖漿、顆粒劑或口服液等,這些劑型易于吞咽,對于兒童安全性更高。如果必須使用成人藥物,應在醫生的指導下調整劑量,并密切觀察孩子的反應。
在用藥過程中,家長應嚴格按照醫囑或藥品說明書進行使用,避免自行增減劑量。同時,使用精確的計量工具(如分藥器、量杯或滴管)來確保劑量的準確性。如果孩子在用藥后出現任何異常反應,如皮疹、呼吸困難、面部或喉嚨腫脹、藥物過量、病情加重等,應立即停藥并咨詢醫生或藥師。
4.4 生物制品抗腫瘤藥不良反應監測情況
生物制品抗腫瘤藥包括單克隆抗體、抗體偶聯藥物、細胞治療藥物等。2024年全國藥品不良反應監測網絡共收到生物制品抗腫瘤藥不良反應/事件報告49,364份,其中嚴重報告24,315份,占49.3%。生物制品抗腫瘤藥占2024年總體報告數量的1.9%。
4.4.1 涉及患者情況
2024年生物制品抗腫瘤藥不良反應報告/事件中,男女患者比為1.22:1。45-64歲年齡組報告例數最多,占43.9%。
4.4.2 涉及藥品情況
2024年生物制品抗腫瘤藥不良反應報告/事件中,數量排名前3位的類別為細胞程序性死亡蛋白1/細胞程序性死亡配體1(PD-1/PD-L1)抑制劑、血管內皮生長因子/血管內皮生長因子受體(VEGF/VEGFR)抑制劑、人表皮生長因子受體2(HER-2)抑制劑,嚴重不良反應報告/事件數量排名前3位的類別與總體一致。
4.4.3 累及器官系統情況
2024年生物制品抗腫瘤藥不良反應/事件報告中,總體報告和嚴重報告的藥品不良反應/事件累及器官系統情況詳見圖13。與生物制品抗腫瘤藥的總體報告相比,嚴重報告的各類檢查、血液及淋巴系統疾病構成比偏高。
4.4.4 監測情況分析及安全風險提示
2024年生物制品抗腫瘤藥不良反應/事件報告數量約占總體報告數量的1.9%,嚴重報告占比高于2024年藥品不良反應/事件總體情況。醫務人員和患者均應重視可能的不良反應/事件,合理用藥、適當預防、及時干預,盡量避免因嚴重不良反應/事件影響治療。
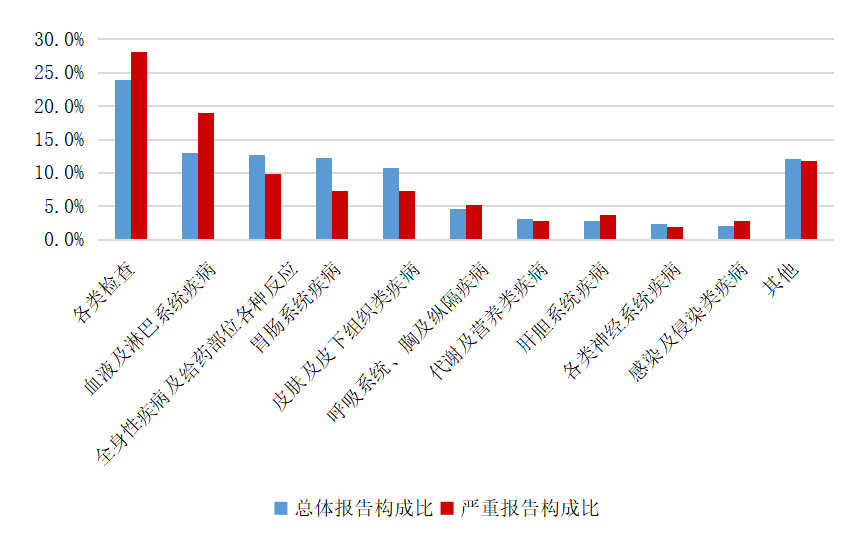
圖13 2024年生物制品抗腫瘤藥不良反應/事件累及器官系統
小貼士:
免疫檢查點抑制劑用于抗腫瘤治療時應注意免疫相關不良事件
以靶向細胞程序性死亡蛋白1(programmed cell death protein 1, PD-1)或其配體的單克隆抗體為代表的免疫檢查點抑制劑(immune checkpoint inhibitors, ICIs),已逐漸成為多種惡性腫瘤的標準治療手段,是腫瘤治療領域的突破性進展之一。ICIs與傳統的細胞毒藥物和小分子靶向藥物在安全性上具有顯著差異,臨床使用免疫檢查點抑制劑用于抗腫瘤治療時應注意免疫相關不良事件(immune-related adverse event, irAE),如免疫相關性心肌炎、免疫相關性肺炎、免疫相關性內分泌疾病等。在開始接受免疫檢查點抑制劑治療前,患者應被告知irAE的相關風險。在出現irAE時,患者應及時向醫務人員報告可疑癥狀并及時就診。醫務人員需對irAE相關癥狀和體征保持警惕,積累ICIs臨床使用和irAE識別處理經驗,通過早識別和早治療減少傷害、降低風險。
4.5 女性生殖系統用藥不良反應監測情況
本報告中的女性生殖系統用藥是指用于女性避孕、保胎、月經不調、更年期綜合征等治療的化學藥品。2024年全國藥品不良反應監測網絡共收到女性生殖系統用藥的不良反應/事件報告3.3萬份,占總體報告的1.3%;其中嚴重報告3877份,占女性生殖系統用藥的11.7%。
4.5.1 涉及藥品情況
2024年女性生殖系統用藥不良反應/事件報告數量、嚴重報告數量排名前3位的藥品類別均是子宮收縮及引產藥、避孕藥、孕激素類及抗孕激素類藥。
2024年女性生殖系統用藥不良反應/事件報告中,注射制劑占50.8%,口服制劑占31.5%,腔道給藥制劑占10.2%,其他劑型占7.5%;嚴重報告中,注射制劑占61.1%,口服制劑占26.2%,腔道給藥制劑占6.8%,其他劑型占5.9%。
4.5.2 累及器官系統情況
2024年女性生殖系統用藥不良反應/事件報告中,總體報告和嚴重報告的藥品不良反應/事件累及器官系統情況詳見圖14。2024年女性生殖系統用藥不良反應/事件報告中,口服制劑累及器官系統排名前5位是胃腸系統疾病、血管與淋巴管類疾病、皮膚及皮下組織類疾病、各類神經系統疾病、精神病類;注射劑累及器官系統排名前5位的是胃腸系統疾病,皮膚及皮下組織類疾病,呼吸系統、胸及縱隔疾病,血管與淋巴管類疾病,心臟器官疾病。
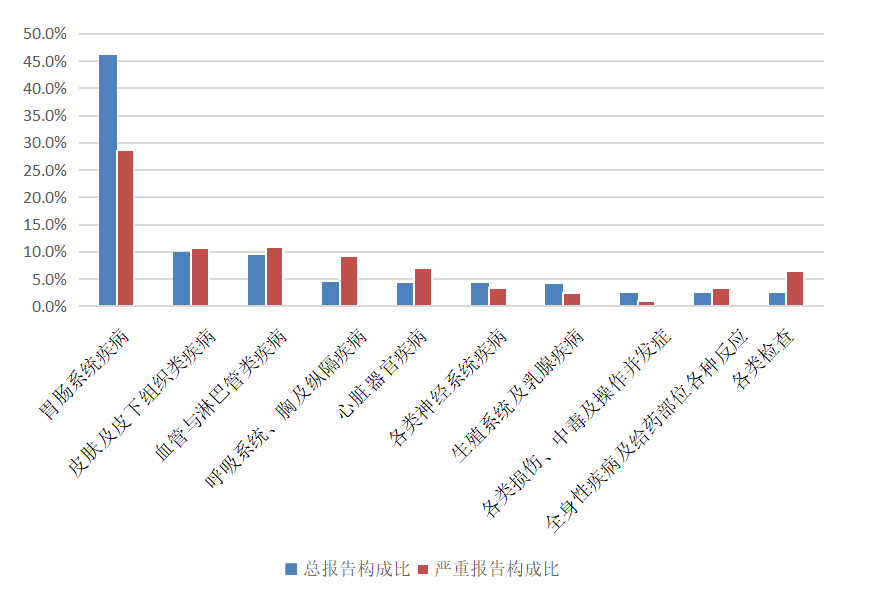
圖14 2024年女性生殖系統用藥不良反應/事件累及器官系統
2024年女性生殖系統用藥嚴重不良反應/事件報告中,口服制劑累及器官系統排名前5位的是胃腸系統疾病,皮膚及皮下組織類疾病,血管與淋巴管類疾病,妊娠期、產褥期及圍產期狀況,心臟器官疾病;注射劑累及器官系統排名前5位的是胃腸系統疾病,呼吸系統、胸及縱隔疾病,皮膚及皮下組織類疾病,血管與淋巴管類疾病,心臟器官疾病。
4.5.3 監測情況分析及安全風險提示
2024年女性生殖系統用藥不良反應/事件報告涉及50個藥品品種,不良反應報告數量占總報告數的1.3%,與總體報告不良反應/事件的增長趨勢基本一致。子宮收縮及引產藥為報告數最多的類別,其次是避孕藥、孕激素類及抗孕激素類藥品。嚴重不良反應/事件報告中,報告數量排名靠前的藥品類別和品種與總體報告基本一致。
小貼士:
女性口服避孕藥的作用機制和不良反應是什么?
常用的口服避孕藥主要是由雌激素類藥物和孕激素類藥物組成的復方制劑。其作用機制是通過人為升高體內激素水平,模擬懷孕狀態,使下丘腦不再分泌促進排卵的激素,從而抑制排卵。另外,避孕藥還通過改變子宮頸黏液性狀,抑制精子穿越,改變輸卵管功能,影響精子運行,改變子宮內膜形態及功能,不利于受精卵著床等諸多環節共同作用,達到避孕目的。部分復方口服避孕藥的包裝內含有兩種藥片,一種是活性片,含有激素成分;另一種是空白片,不含任何激素成分,設計空白片是為了防止漏服,能更好地幫助女性規律、連續服用藥品。
避孕藥是激素類藥物,可能會影響女性的內分泌功能,引發月經不調、推后或延長、陰道出血,或頭痛、乳房賬痛、擇食等輕微類早孕反應。長期使用可能影響腸胃功能,出現惡心、嘔吐、食欲不佳等癥狀。避孕藥可引起凝血功能亢進,可引起血栓靜脈炎,或血栓栓塞。其他不良反應包括痤瘡、皮膚色素沉著、血壓升高等。所以口服避孕藥首次使用時建議在醫師指導下使用,應當認真閱讀藥品說明書,了解藥品的用法用量和不良反應,做到合理用藥,才能減少對身體健康的不良影響。
第5章 有關說明
5.1 本年度報告中的數據來源于國家藥品不良反應監測數據庫中2024年1月1日至2024年12月31日各地區上報的數據。
5.2 與大多數國家一樣,我國藥品不良反應報告是通過自發報告系統收集并錄入到數據庫中的,存在自發報告系統的局限性,如漏報、填寫不規范、信息不完善、無法計算不良反應發生率等。
5.3 每種藥品不良反應/事件報告的數量受到該藥品的使用量和不良反應發生率等諸多因素的影響,故藥品不良反應/事件報告數量的多少不直接代表藥品不良反應發生率的高低或者嚴重程度。
5.4 本年度報告完成時,其中一些嚴重報告尚在調查和評價的過程中,所有統計結果均為現階段數據收集情況的真實反映,并不代表最終的評價結果。
5.5 本年度報告相關醫學術語統計采用人用藥品技術要求國際協調理事會(ICH)監管活動醫學詞典(MedDRA)。MedDRA是在ICH主辦下編制的標準化國際醫學術語集,用于與人用醫療產品相關的監管溝通和數據評估。各類檢查是MedDRA中的一項系統器官分類,包括有限定詞(例如:升高、降低、異常、正常)和沒有限定詞的檢查名稱。
5.6 專業人士會分析藥品與不良反應/事件的關聯性,提取藥品安全性風險信息,根據風險的普遍性或者嚴重程度,決定是否需要采取相關措施,如在藥品說明書中加入安全性信息,更新藥品如何安全使用的信息等。當藥品的獲益不再大于風險時,藥品也會撤市。
5.7 本年度報告數據均來源于全國藥品不良反應監測網絡,不包含疫苗不良反應/事件的監測數據。目前,全國藥品不良反應監測網絡中的化學藥品、中藥、生物制品基于藥品特點采用不同分類,相關表述存在不同。







