近日,四川科倫博泰發布公告稱,已獲得美國FDA批準其啟動潛在同類首創ADC藥物SKB518臨床研究的新藥臨床試驗(IND)申請。
據科倫博泰新聞稿,SKB518是一款針對靶點生物學特點,利用科倫博泰OptiDCTM平臺技術研發的靶向蛋白酪氨酸激酶7(PTK7)的抗體偶聯藥物(ADC),在臨床前展現了良好的有效性和安全窗,擬用于治療晚期實體瘤。此前,2024年6月,該藥已獲得NMPA的IND批準,用于晚期實體瘤。中美雙雙獲批臨床,標志著SKB518的全球同步開發策略正穩步推進。
蛋白酪氨酸激酶7(PTK7)是一種Wnt輔助受體,在正常上皮、內皮和造血組織中低水平表達,但在結腸癌、胃癌、肺癌和急性髓系白血病等惡性腫瘤中呈現mRNA轉錄水平顯著上調。這種跨癌種過表達特征使其成為ADC療法的新興治療靶點。
除了SKB518,目前全球還有多款PTK7 ADC藥物正在開發中,并已有部分產品成功授權出海:
2024年6月,Day One Biopharmaceuticals宣布引進Mabcare Therapeutics的PTK7 ADC新藥MTX-13的大中華區外全球權益。根據協議,Day One支付5500萬美元預付款,11.52億美元里程碑金額,以及低至中個位數比例的銷售分成。
2024年11月,IDEAYA Biosciences宣布選擇IDE034,一種潛在的首創B7H3/PTK7 TOP1載荷雙抗藥物偶聯物(BsADC),作為開發候選藥物,并行使了其對百奧賽圖(Biocytogen)潛在的首創B7H3/PTK7 BsADC項目的全球獨家許可權。根據IDEAYA和百奧賽圖之間的選項和許可協議,該選項是為獲得百奧賽圖的全球獨家許可而行使的。IDEAYA將向百奧賽圖支付預付款和期權行使費,以及額外的開發和監管里程碑付款、商業里程碑付款和凈銷售額的版稅,總計4.065億美元,包括高達1億美元的開發和監管里程碑付款。
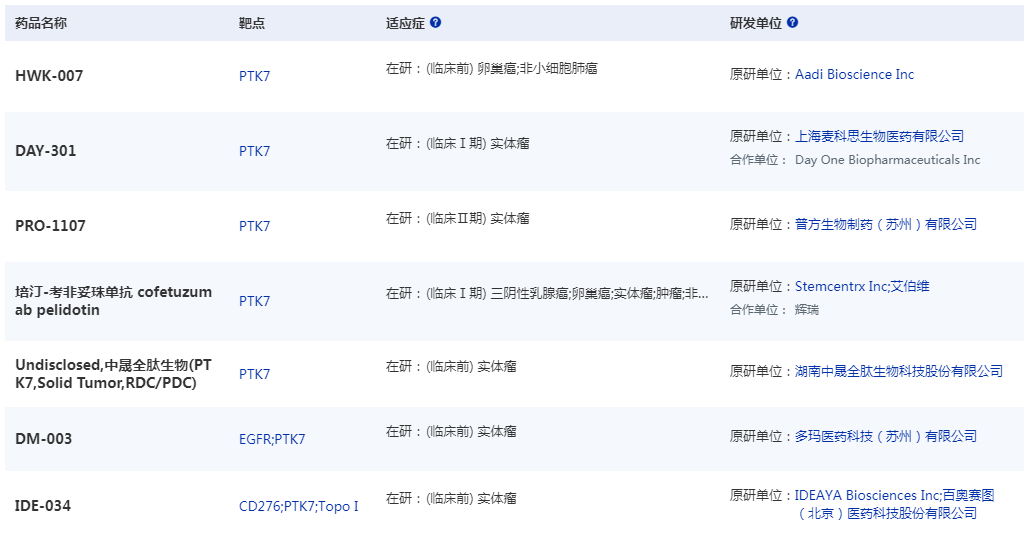
圖1全球在研PTK7 ADC藥物
圖片來源:藥智數據
值得注意的是,科倫博泰此前授權默沙東的SKB264(MK-2870)、SKB315(MK-1200)和SKB410(MK-3120)三大臨床階段項目均采用了相同的毒素linker策略。但以SKB518為代表的新一代ADC項目在毒素linker選擇上已從原有方案轉向行業主流技術GGFG-Dxd平臺,體現了科倫博泰的自我進化與升級。
目前,科倫博泰已有1個ADC項目獲批上市,1個ADC項目處于NDA階段,多個ADC或新型ADC項目處于臨床或臨床前研究階段。
結語
科倫博泰是科倫藥業控股子公司,是國內ADC龍頭和創新藥出海代表,其已與跨國大藥企默沙東達成上百億美元合作。而在國內已成功推出了首款國產TROP2靶向ADC——蘆康沙妥珠單抗。
SKB518在美國獲批IND,進一步壯大了科倫博泰ADC藥物走向世界的隊伍,也顯示出國內企業在ADC賽道上的持續創新能力。







