在腫瘤治療領域,歷經20年沉寂的DLL3靶點,正以顛覆性姿態重塑小細胞肺癌(SCLC)等神經內分泌腫瘤的治療格局。作為Notch通路的抑制性配體,DLL3憑借其高表達于腫瘤細胞、近乎零表達的“干凈”正常組織分布,以及獨立于PD-L1等傳統靶點的調控機制,成為精準治療的新星。
2024年安進塔拉妥單抗的加速獲批,不僅驗證了DLL3靶向治療的臨床價值,更點燃了全球藥企對這一領域的研發熱情,短短兩年內超10項重磅交易、超40款在研管線噴涌而出,昭示著DLL3靶點從“冷門”向“必爭之地”的躍遷。
2025年4月24日,再鼎醫藥宣布靶向DLL3的ADC ZL-1310用于治療小細胞肺癌的全球1期臨床研究數據將在2025年美國臨床腫瘤學會(ASCO)年會上公布。而深究之下,除ZL-1310之外,本次ASCO大會上安進的Tarlatamab、Gensun的ZG-006、勃林格殷格翰的BI-764532、Phanes的Peluntamig以及諾華的LB2102等諸多DLL靶向新藥均不約而同地選擇在此大會上露臉。
短短幾年,DLL3到底是如何走進研究者的視野中?又是如何轉瞬間成為ASCO的熱門?更關鍵的是,在上述管線之外,現階段的DLL3靶向藥領域究竟是怎樣的格局?
20年沉寂
DLL3靶點負重而行
所謂DLL3,即Notch信號通路的抑制性配體,屬于DLL家族(包括DLL1、DLL3、DLL4),近年來因其在腫瘤治療中的獨特潛力逐漸成為較為創新的潛力靶點。
而其之所以能成為腫瘤治療的關鍵靶點,主要原因有四:
高表達特性:作為靶向性的載體,DLL3在部分腫瘤中的高表達特性決定了其主要潛力,比如研究表明,其在85%的SCLC患者腫瘤細胞中高度表達,使其成為一個廣泛適用的治療靶點。
高特異性:由于靶向治療過程中,需要嚴格區分腫瘤與非腫瘤環境,因此DLL3在正常組織中幾乎不表達的特性,使其成為部分腫瘤的精準治療靶點,可以極大地減少正常組織的損傷。
獨立的作用機制:由于DLL3表達水平由ASCL1轉錄因子調控,其獨立于如PD-L1等療法,且疾病過程中相對穩定,這使其可作為PD-L1陰性或對免疫檢查點抑制劑等療法無效患者的替代治療選擇。
潛在影響足:高表達DLL3的患者在BiTEs和ADC研究中的療效可能更佳,但具體的生物標志物作用仍需進一步研究,以明確DLL3表達水平與治療反應的直接相關性。
數據來源:公開數據整理
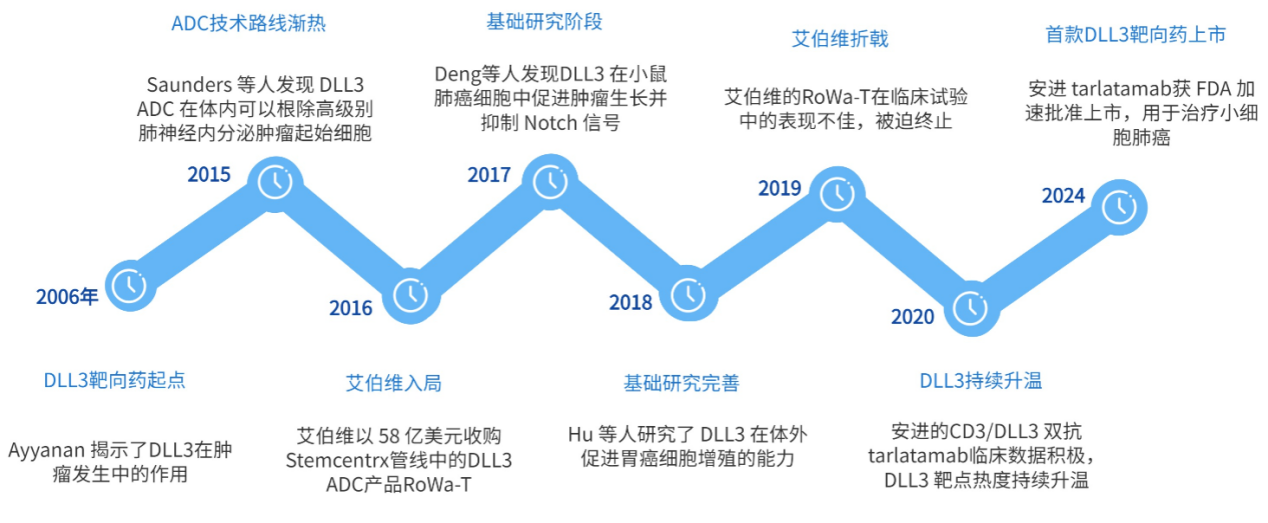
而縱觀歷史,從2006年Ayyanan揭示了DLL3在腫瘤發生中的作用以來,到2024年全球首款DLL3靶向獲得FDA加速批準上市,可以發現DLL3靶點的研究開發歷史明顯不及PD-1、GLP-1等絕大多數熱門療法。
但是,就是如此一個新生代靶點反向卻又有何魅力引得市場青睞,以至于諸多MNC不惜失敗也要接連入局?
一款產品
引發領域頻繁交易
近年以來,隨著DLL3作為抗腫瘤靶點的潛力顯現,其作為靶向療法得以在當下快速發展,抗體偶聯藥物(ADC)、雙特異性T細胞接合器(BiTE)、嵌合抗原受體T細胞療法(CAR-T)以及RDC/PDC等不同的技術方向,通過不同的機制,實現對腫瘤的精準打擊。
2024年,安進自主研發的塔拉妥單抗(Tarlatamab)DLL3靶向療法成功獲FDA批準上市,其技術方向選用的則是雙特異性T細胞接合器(BiTE),通過連接DLL3陽性癌細胞和CD3陽性 T 細胞,引發MHC-I非依賴性 T 細胞活化,促進腫瘤細胞裂解。
市場表現方面,自2024年5月上市后,Tarlatamab僅用半年時間,銷售額就已達到1.15億美元。而隨著其適應逐漸從二線向一線擴展,資本市場預測其銷售峰值可能會達到15-20億美元,之后則需要依靠多維度適應癥擴展來進一步提高市場天花板。
適應癥方面,Tarlatamab率先獲批上市的適應癥為“小細胞肺癌”(源于在85%的SCLC患者中高表達);其次是“非小細胞肺癌”適應癥,目前已進入注冊申請階段;前列腺癌、神經內分泌前列腺癌等適應癥臨床進度則相對靠前,尚處于臨床I期階段。
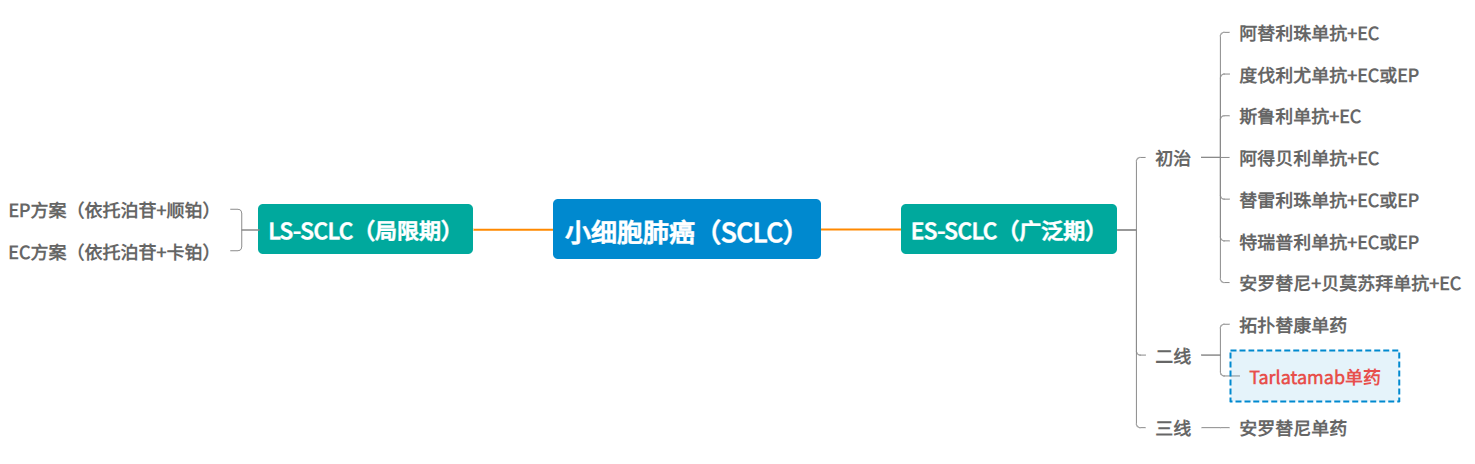
圖注:SCLC臨床常用治療方案
數據來源:2025 CACA小細胞肺癌診治指南
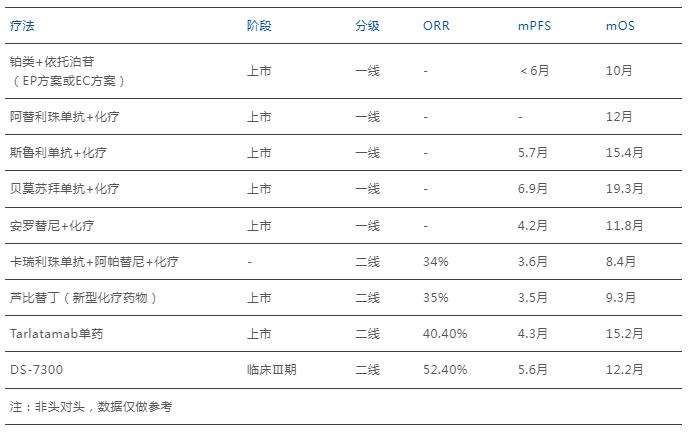
針對已獲批的“小細胞肺癌”適應癥,Tarlatamab主要用于鉑類化療后疾病進展的廣泛期小細胞肺癌成人患者,目前尚處于ES-SCLC的二線療法,其療法最大突破性意義有二,一者一定程度上解決了經治ES-SCLC患者的耐藥問題;二者取得了前所未有的持久臨床緩解及超長的生存獲益,將已治ES-SCLC患者的中位無進展生存期,從平均4.9個月提升到了17.9個月,甚至比很多一線治療還長(下圖)。
ES-SCLC的抗癌療法數據對比
數據來源:公開數據整理
并且,Tarlatamab作為DLL3靶向療法的代表產品,其并未止步于二線療法,相反,其還同時還開展了一系列聯合療法與一線療法的頭對頭實驗。如果Tarlatamab最終能拿出驚艷的結果,或將帶領整個DLL3靶向藥領域邁入一個全新的階段。
很明顯,Tarlatamab無論是ORR、mPFS與mOS方面均明顯優于同類二線療法,甚至超越部分一線聯合療法。側面預示著DLL3靶向藥在SCLC領域的強大競爭優勢,未來甚至有望成為該領域中的顛覆性療法類型。
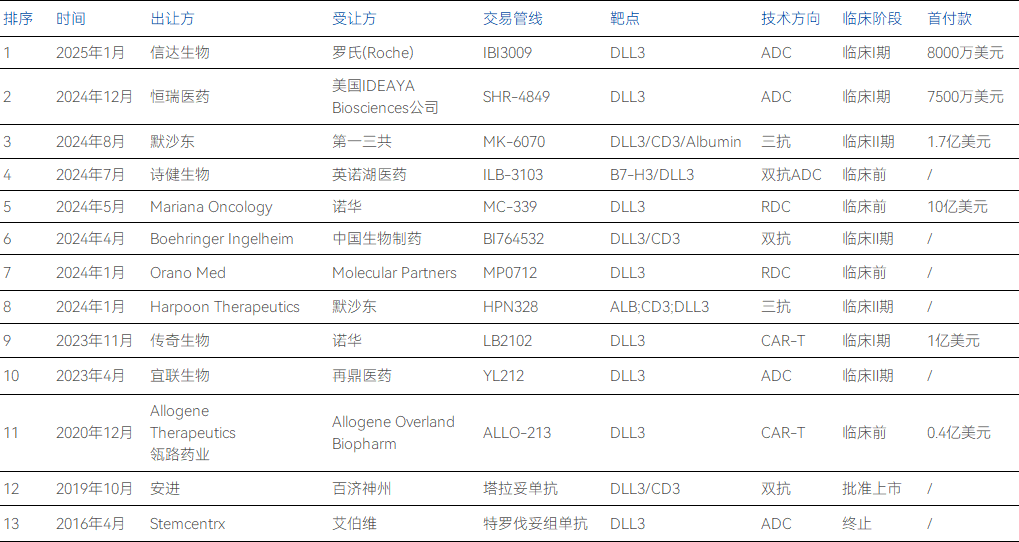
而事實上,市場層面已有不少企業開始注意到了DLL3靶點的潛在優勢,兩年時間內已有超過10項BD交易集中于此,其中不乏體量巨大的MNC藥企。
部分DLL3靶點管線交易情況
數據來源:藥智數據(點擊查看大圖)
2016年6月,艾伯維以58億美元收購Stemcentrx,將其重要資產Rova-T(DLL-3 ADC)收入囊中,可惜Rova-T在后來的Ⅲ期中表現不盡如人意,被迫終止。
2023年11月,諾華以1億美元首付款+10.1億美元里程碑付款,獲得傳奇生物處于Ⅰ期臨床的靶向DLL3 CAR-T療法,再度將DLL3靶點拉到了舞臺中央。
2024年1月,默沙東通過6.8億美元的整體收購拿下Harpoon Therapeutics公司,由此獲得后者一款DLL3/CD3/Albumin三抗MK-6070(HPN328),又在7個月后將該管線除日本外的全球權益授權給了日本藥企巨頭第一三共,僅首付款已達1.7億美元。
2024年5月,諾華斥資10億美元收購了Mariana Oncology及其前景廣闊的產品線,其核心是MC-339,這是一種正在小細胞肺癌(SCLC)中進行研究的基于錒的治療藥物。
2024年12月,恒瑞醫藥宣布將其DLL3 ADC(SHR-4849)的海外權益以7500萬美元首付及超10億美元的總額授權給美國IDEAYA Biosciences公司。SHR-4849于2024年6月獲批臨床并于12月公布早期臨床數據,在小細胞肺癌(SCLC)的1期臨床研究中展現了73%(8/11)的總應答率(ORR)。
2025年1月,信達生物宣布與羅氏達成DLL3 ADC(IBI3009)的全球獨家許可協議,首付款8千萬美元,總額約10億美元。IBI3009目前已在澳大利亞、中國和美國獲得臨床申請(IND)批準,并于2024年12月完成1期臨床研究首例患者給藥。
很明顯,從全球首款DLL靶向藥因表現不佳而被迫終止,到塔拉妥單抗成為全球首款獲批上市的DLL3靶向藥物,該領域的受關注程度正在有目共睹的提升,兼具成藥性與商業化可能的潛力也讓越來越多制藥企業加入競爭,未來可期。
40種新藥
ADC、BiTE已為在研主導
在全球制藥企業緊鑼密鼓入局DLL3靶向藥的同時,該領域的全球在研管線數量也水漲船高,截至目前全球在研DLL3管線超過40款,其中活躍管線占比超60%(共計26款)。
就臨床階段而言,26款活躍DLL3管線中,絕大多數均處于臨床前期階段,其中活躍臨床Ⅲ期管線僅Rova-T一款(終止)、活躍臨床Ⅱ期管線6款、臨床I期管線9款、臨床申請與臨床前管線9款。
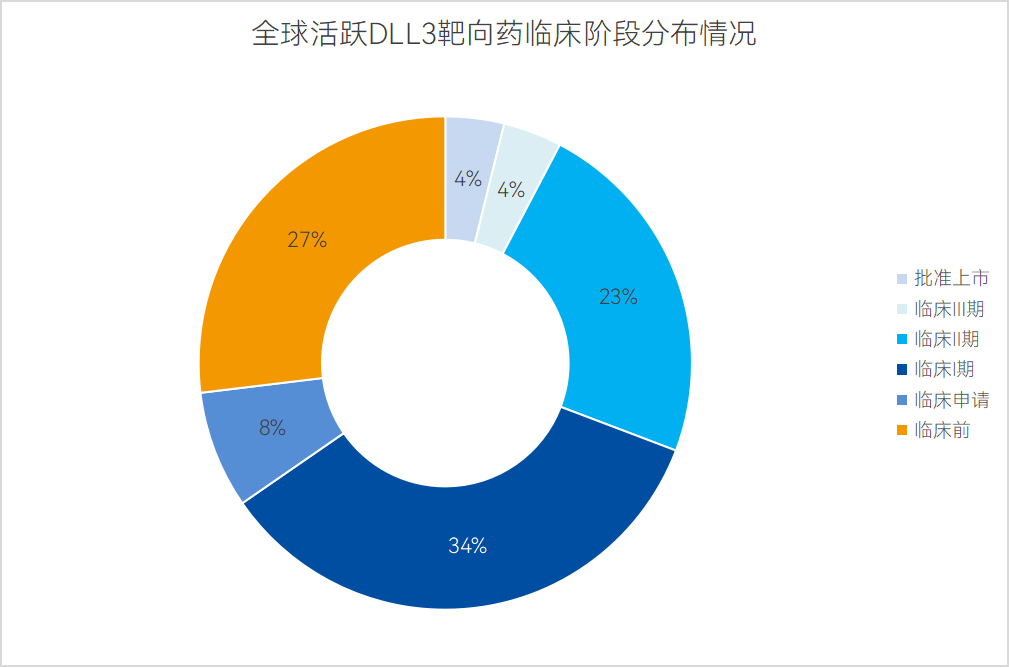
數據來源:藥智數據
就技術方向而言,ADC、TCE(包括BiTE與TiTE)是現階段DLL3靶向藥領域最主要的技術方向,其中TCE數量最多,可分為BiTE(雙特異性T細胞銜接器)與TiTE(三特異性T細胞銜接器)兩類,分別有6款與7款新藥管線;之后是ADC技術領域,共有8款活躍管線在研,占比30%;最后,CAR-T、RDC、普通雙抗雖數量不多,但也是DLL3靶點的重要潛力方向之一。
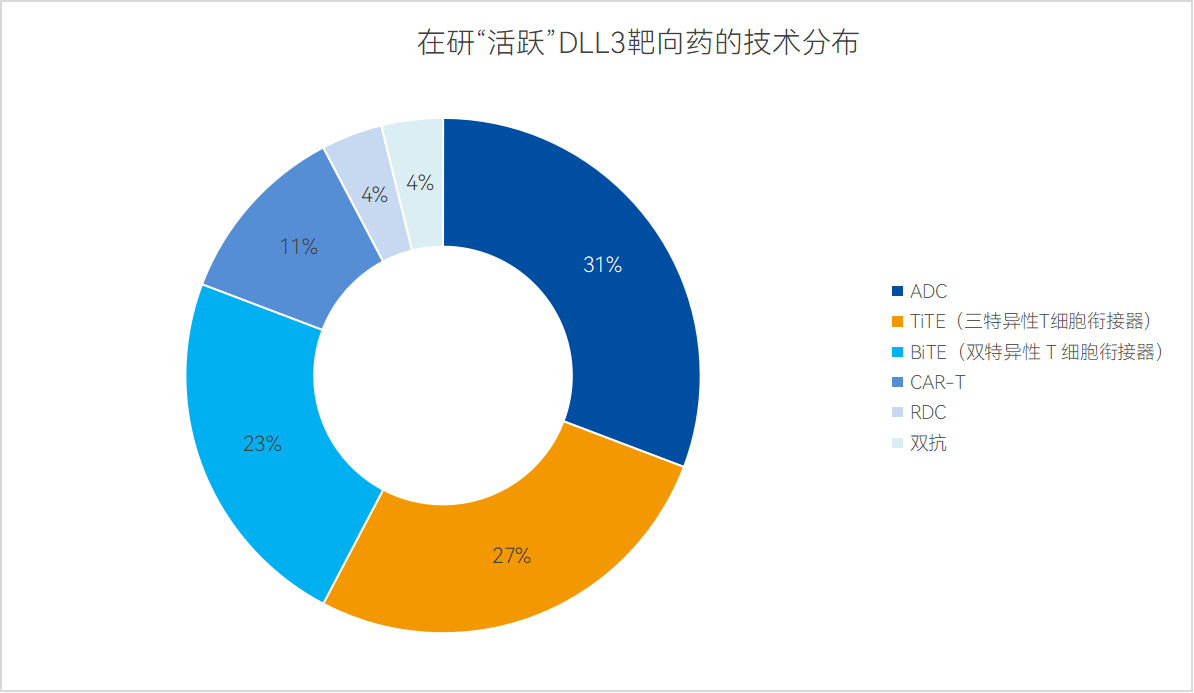
數據來源:藥智數據
在BiTE(雙特異性T細胞銜接器)技術方向上,作為DLL3靶向藥領域最早誕生的類型,是早期企業布局的主要方向,但目前該技術層面已有安進的塔拉妥單抗獲批上市,這對后續在研管線研發有一定不利影響,目前在研管線分別有勃林格殷格翰的BI-764532(臨床Ⅱ期)、齊魯制藥的QLS-31904(臨床I期)、信達生物的IBI115(臨床申請)等。
在TiTE(三特異性T細胞銜接器)技術方向上,作為迭代技術,其理論上可具備更靈活的靶向策略,實現多種作用機制并存的同時,有利于將藥物重定向至腫瘤局部,增加結合特異性,提升藥物靶向腫瘤細胞的準確性,降低脫靶毒性,增強抗腫瘤能力。目前全球領域尚無任何三抗獲批上市,更別提DLL3的TiTE層面,目前活躍TiTE層面臨床進展最快的為Gensun的ZG-006、Harpoon的HPN-823與默沙東的HPN-328,三者均處于臨床Ⅱ期階段。
在ADC技術方向,其作為國內優勢領域,與TiTE中國產藥企管線數量稀少有所不同,在該領域中國內管線占據主要,再鼎醫藥的ZL-1310(臨床Ⅱ期)、信達生物的IBI-3009(臨床I期)、恒瑞醫藥的SHR-4849(臨床I期)與復旦張江的FZ-AD005(臨床I期)均是極具代表性的管線。
總體來看,Tarlatamab作為行業的顛覆者,其為整個DLL3靶向藥領域帶來了全新的市場格局,打破了ES-SCLC原有患者臨床僅PD-1+化療可用的窘境等各方面的成就值得肯定。
但同時,其也并非完全不可超越,相反,在目前不同技術方向的數十款新藥中,也有不少潛力管線有望在療效、安全性以及給藥便利性方面,做出巨大的改善。
結語
從BiTE、ADC到三抗與CAR-T,很明顯DLL3靶向治療的技術迭代正以前所未有的速度推進,而跨國藥企的頻繁BD與管線布局,更凸顯其商業化潛力。
盡管挑戰猶存——如生物標志物驗證不足、脫靶毒性風險等,但以塔拉妥單抗為代表的DLL靶向藥在LS-SCLC領域的療效突破已為行業注入強心劑。
未來,隨著前線治療數據的揭曉、多技術路徑的協同探索,DLL3靶點或將從“潛力股”蛻變為腫瘤精準治療的新支柱,為患者帶來更高效、更低毒的治療選擇。
而對于更關鍵的“DLL3競爭格局”而言,其三大特征有望繼續延續:
?技術路徑百花齊放?:ADC(如再鼎ZL-1310的73%ORR5)、三抗(默沙東HPN328的精準靶向設計)等創新機制持續突破,形成對BiTE療法的補充與超越。
?臨床價值縱深拓展?:安進Tarlatamab向一線治療邁進,若驗證其對PD-L1陰性患者的替代價值,或將重構SCLC全程治療體系。
?全球化研發競速?:恒瑞、信達等中國藥企通過BD快速切入賽道,諾華、默沙東等MNC則通過收購加速技術整合,形成跨國跨技術平臺的立體競爭網絡。
展望未來,DLL3靶向藥的真正潛力或許還未完全釋放,SCLC某種層面來看更像是DLL3靶向藥全面進軍的敲門磚,這場靶向革命有望向著更宏偉的經內分泌腫瘤疆域延伸。







